NMPAとは

化粧品・医薬品(原薬・包装・添加物含む)・医療機器を一般貿易で中国へ輸出する場合はNMPA 【中国国家薬品監督管理局】の行政認可を取得しなければなりません。
(2018年まではCFDA【国家食品薬品監督管理局】という呼称でした)
WWIPの取り組みと実績

NMPA申請/登記を行うためには、以下の点に注意しながら申請準備を進める必要があります。
- 中国で使用可能な成分か?
- 中国で「化粧品」カテゴリに該当するか?
- 自社はNMPA申請適格者か?
- 中国国内に登記された「境内責任者」として、協力企業はあるか?
- サンプルの検査実施が必要
- 申請書類の準備が必要(製造工場、原料メーカー様にも協力していただく必要あり)
2021年に大きな法改正が行われたこともあり、手続き方法が非常に複雑かつ難解です。
WWIPは、お客様の製品のNMPA認可を迅速に取得するサポートを行なっております。
WWIPの実績
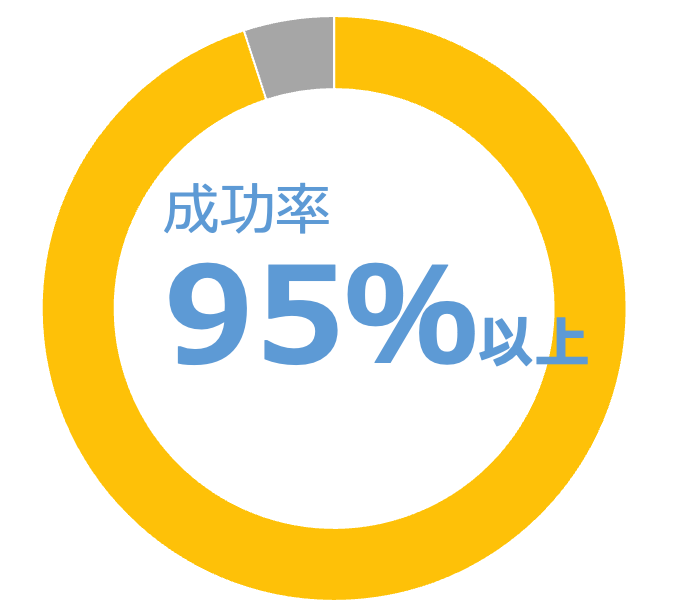
1.豊富な申請実績
新条例施行以降も多数ご依頼を承っており、順次許可取得しております。
新条例により要求は厳しくなっているものの、製品カテゴリ・処方が中国の化粧品要求に沿ったものであれば通過できると考えております。
もし、弊社の手続き上の過失により不許可となった場合、弊社の申請代行費用を全額返金することを契約書に明記しています。
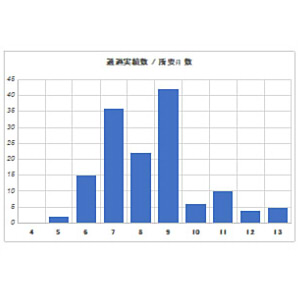
普通化粧品の手続き所要時間
旧条例下で、弊社にて申請業務をサポートした普通化粧品は、業務着手から販売開始できる状態までの所要時間が「平均9ヶ月以内」でした。
新条例下では書類要求が増えているためもう少々時間を要しますが、「順調に進んだ場合に約7〜8ヶ月」、平均的には1年ほどとお考えください。
ちなみに特殊化粧品の場合は検査とNMPA審査の時間が長いため1年以上要します。
提案書一覧
化粧品NMPA申請
提案書
化粧品原料品質安全関連情報
登録代行サービス提案書
化粧品NMPA新原料申請
提案書
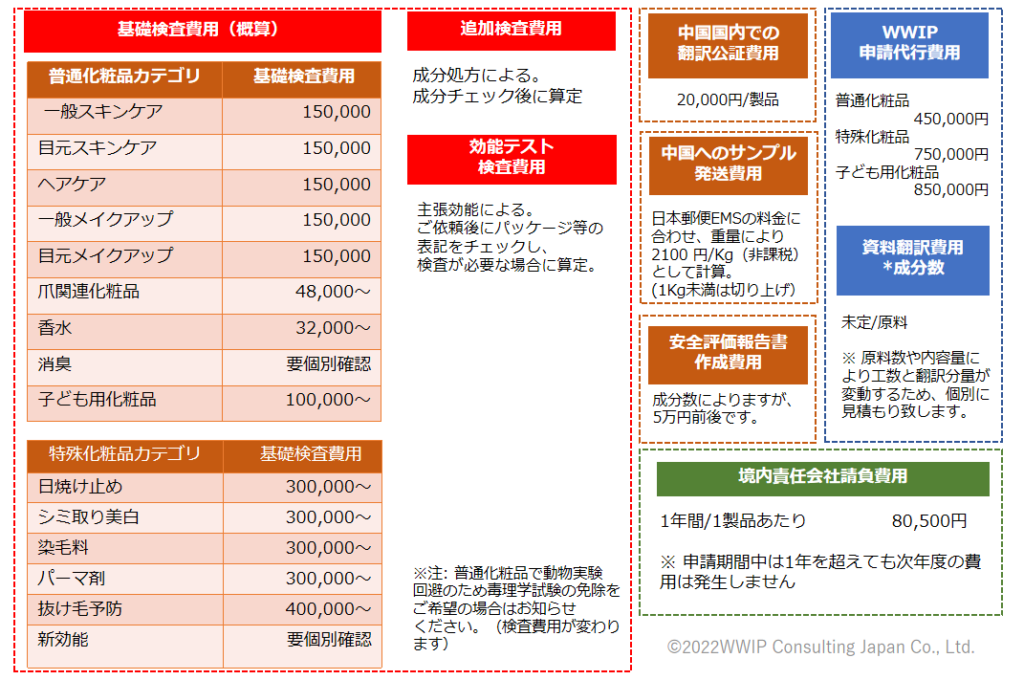
化粧品NMPA申請時に必要な費用
成分チェックサービス
貴社製品の成分の中国での使用可否をチェックするサービスです。
「1企業様・1か月あたり・1製品まで無料」です。
ご希望の場合はメールかお電話にてお問合せください。
成分情報をお知らせいただく際には、以下より「成分チェックシート」をダウンロードしご使用ください。
- 2製品目以降は「1製品あたり8,800円(税込)」にて対応。
その後WWIPにNMPA申請代行のご依頼をいただいた場合は、申請代行費より成分チェック費用を相殺させていただきます。 - 原料の使用可否や制限容量だけでなく、原料の「最高歴史使用量」のチェックも併せて行います。
- 「月極コンサルティングサービス」ご契約のお客様は、契約条件に応じてチェック致します。
各リストと化粧品安全技術規範
化粧品安全技術規範は、化粧品の安全性に関する技術的な要求事項について定めたもので、一般的な要求事項、使用禁止成分、使用制限成分に関する要求事項および検証評価方法などが含まれています。
ネガティブリスト
化粧品安全技術規範第二章の内容として、現在発表されている最新版のガティブリストです。
使用可否を確認したい成分がリスト収載されているかどうかチェックするためにお役立てください。
(「Control + F」でINCI名検索できます)

ポジティブリスト
以下、現在発表されている最新版のポジティブリストリストです。
使用可否を確認したい成分がリスト収載されているかどうかチェックするためにお役立てください。
(「Control + F」でINCI名検索できます)

- いわゆるポジティブリストと呼ばれる「既使用化粧品原料目録」は、過去に中国で使用されたことのある原料のリストであり、そのほとんどが使用可能ですが、一部、現在は禁止されている原料も含まれます。
アラウドリスト
化粧品安全技術規範第三章では、化粧品の成分に関する要求が定められています。最新版は2015年版、現在2022年版の意見募集稿が公表されています。
中国化粧品で使用可能な防腐剤・着色剤・紫外線散乱/吸収剤・染髪剤成分など、使用可能だが含有量や使用範囲の制限があるもののリストと制限の内訳を表示しています

化粧品監督管理条例( 2021年施行)新旧比較
以下、2022年7月12日現在の主な法規発表状況です。
《確定版 実務細則》
- 化粧品登録登記管理弁法(2021.01.07公布/2021.05.01施行)
- 化粧品新原料登録登記申請管理規定(2021.03.04公布/2021.05.01施行)
- 化粧品登録登記資料管理規定(2021.03.04公布/2021.05.01施行)
- 化粧品分類規則と分類目録(2021.04.09公布/2021.05.01施行)
- 化粧品安全評価技術ガイドライン(2021.04.09公布/2021.05.01施行)
- 化粧品効能宣伝評価規範(2021.04.09公布/2021.05.01施行)
- 化粧品ラベル管理弁法(2021.06.03公布/ 2022.05.01施行)
- 化粧品生産品質管理規範 (2022.01.06公布/2022.07.01施行)
- 化粧品副作用監視測定管理弁法(2022.02.23公布/2022.10.01施行)
- 特殊化粧品のカテゴリと許可期間の変更
- 新原料申請に備案(届出)制度を導入
- NMPA申請/備案主体者の要件
- 歯磨き粉にNMPA備案手続きが必要になった
- 罰則強化
| 化粧品監督管理条例 | 旧条例との比較と注意点 |
|---|---|
| <4条> 国家はリスクの程度に応じて化粧品・化粧品原料に対し分類・管理を行う。 化粧品は特殊化粧品と普通化粧品に分かれる。国家は特殊化粧品に対しては登録管理を行い、普通化粧品に対しては備案管理を行う。 化粧品原料は新原料と既使用原料に分かれる。国家はリスクの程度が比較的高い化粧品の新原料に対しては登録管理を行い、その他の化粧品の新原料に対しては備案管理を行う。 | 全ての化粧品新原料は「登録管理」を行っていた。 |
| <6条> 化粧品の登録者・備案者は化粧品の品質・安全性・効能効果の標榜に対し責任を負う。 化粧品生産事業者は法律・法規・強制性国家基準・技術規範に照らして生産事業活動を行い、管理体制を強化し、誠実さと自己規律を以て、化粧品の品質・安全性を保証しなければならない。 | 効果効能の標榜に対する責任については言及されていなかった。 |
| <11条> 本国の領土内で初めて化粧品に使用する天然或いは人工の原料を化粧品新原料と言う。 防腐・紫外線保護・着色・染髪・シミ取り・美白効果を有する化粧品新原料は、国務院薬品監督管理部門を通じて登録完了後に使用することができる。その他の化粧品新原料は、使用前に国務院薬品監督管理部門に対し備案をしなければならない。国務院薬品監督管理部門は科学研究の発展に基づき、登録管理をおこなう化粧品新原料の範囲を調整し、国務院の承認後にそれを実施することができる。 | 全ての化粧品新原料は「登録管理」を行っていた。 |
| <13条> 国務院薬品監督管理部門は化粧品新原料登録申請を受理した日から起算して3営業日以内に申請資料を技術審査機構に渡さなければならない。技術審査機構は申請資料を受け取った日から起算して90営業日以内に技術審査を完了し、国務院薬品監督管理部門に対し審査意見を提出しなければならない。国務院薬品監督管理部門は審査意見を受け取った日から起算して20営業日以内に決定をしなければならない。 要件に合致しているものに対しては、登録をおこなった上で化粧品新原料登録証を発行する。要件に合致していないものに対しては、登録をおこなわず書面による理由の説明をおこなう。化粧品新原料の備案者が国務院薬品監督管理部門のオンライン政務サービスプラットフォームを通じて本条例に規定される備案資料を提出すると、備案は即時完了する。 国務院薬品監督管理部門は、化粧品新原料の承認・登録の日、或いは備案者が備案資料を提出した日より起算して5営業日以内に登録・備案に関する情報を公表しなければならない。 | 全ての化粧品新原料は「登録管理」を行っていた。 |
| <14条> 登録・備案を経て化粧品新原料の使用を開始して以降3年間は毎年、新原料登録者・備案者は国務院薬品監督管理部門に対し新原料の使用及び安全状況について報告をしなければならない。安全上の問題が存在する化粧品新原料に対しては、国務院薬品監督管理部門が登録或いは備案の取消しをおこなう。3年の期間が満了するまで安全上の問題が発生していない化粧品新原料については、国務院薬品監督管理部門が制定する既使用化粧品原料のリストに追加される。 登録・備案を経た化粧品新原料が既使用化粧品原料のリストに追加される迄は、依然として化粧品新原料の規定に基づき管理される。 | 3年間の安全報告義務はなく、登録された新原料の発布後は、国務院薬品監督管理部門の制定する既使用化粧品原料のリストに自動的に追加されていた。 |
| <16条> 染毛・パーマ・シミ取り・美白・紫外線保護・抜け毛予防に用いる化粧品及び新効能を標榜する化粧品を特殊化粧品と言う。特殊化粧品以外の化粧品を普通化粧品と言う。 国務院薬品監督管理部門は化粧品の効能効果の標榜・作用部位・製品の剤形・対象者層等の要素に基づき、化粧品の分類規則及び分類リストを制定・公布する。 | 特殊用途化粧品には、染髪・パーマ・シミ取り美白・紫外線保護・育毛・脱毛・美乳・美容健康・除臭の9種類の製品が含まれていた。 |
| <18条> 化粧品の登録申請者・備案者は以下の条件を満たさなければならない。 (一)合法的に設立した企業或いはその他組織。 (二)登録申請や備案手続きをおこなう製品に適した品質管理体系を有する。 (三)化粧品の副作用を監視・測定し評価する能力を有する。 | 化粧品登録・備案者に品質管理体系・副作用監視測定及び評価能力の資質要件はなかった。 |
| <22条> 化粧品の効能効果の標榜に関しては、十分な科学的根拠を有さなければならない。化粧品登録者・備案者は国務院薬品監督管理部門の規定する専用ウェブサイト上で効能効果の標榜の根拠となる文献資料・研究データ・製品効能評価資料の摘要を公表し、社会からの監督を受けなければならない。 | 日焼け止めのSPF/PFA試験は実施されてきたが、「保湿」等の効能の根拠まで要求を受けることはなかった。 |
| <24条> 特殊化粧品登録証の有効期間は5年間である。有効期間の満了時に登録の延長が必要な場合は、有効期間満了の30営業日前迄に提出登録延長の申請を提出しなければならない。本条第二款に規定される状況を除き、国務院薬品監督管理部門は特殊化粧品登録証の有効期間満了以前に延長可否の决定を下さなければならない。期間を過ぎても決定がなされない場合は、延長されたものとみなす。 下記の状況に当てはまるもについては、登録の延長をおこなわない。 (一)登録者が規定の期限内に登録延長申請を提出しなかった。 (二)強制性国家基準・技術規範が改訂され、登録延長を申請する化粧品が改訂後の基準・技術規範の要件に適合しなくなった。 | 特殊用途化粧品登録証の有効期限は4年だった。 |
| <30条> 化粧品原料・直接化粧品に接触する包装材料については、強制性国家基準・技術規範に適合しなければならない。 | 化粧品原料及び直接化粧品と接触する包装材料の管理が強化された。 |
| <31条> 化粧品登録者・備案者・生産受託企業は、原料及び直接化粧品と接触する包装材料の入荷検査記録制度・製品販売記録制度を確立・実施しなければならない。入荷検査記録と製品販売記録は真正且つ完全であり、遡及可能であることを保証し、保存期間は少なくとも製品使用期限満了後1年間とする。製品使用期限が1年に満たない場合は、記録保存期間少なくとも2年間とする。 | 化粧品原料及び直接化粧品と接触する包装材料の管理が強化された。 |
| <32条> 化粧品登録者・備案者・生産受託企業は品質安全責任者を設け、相応の製品品質安全管理及び製品発送の職責を担わせなければならない。 品質安全責任者は化粧品品質安全に関連する専門知識を有し、化粧品生産或いは品質安全管理業務における5年以上の経験を有していなければならない。 | 品質安全責任者の申告は必要なかった。 |
| <36条> 化粧品のラベルには以下の内容を表記しなければならない。 (一)製品名称、特殊化粧品登録証番号。 (二)登録者・備案者・生産受託企業の名称・住所。 (三)化粧品生産許可証番号。 (四)製品実施の基準番号。 (五)全成分。 (六)正味重量。 (七)使用期限・使用方法・必要な安全上の注意。 (八)法律・行政法規・強制性国家基準が規定する表記しなければならないその他の内容。 | 委託先製造元の情報記載の要求はなかった。 |
| <46条> 薬品監督管理を担当する部門は化粧品の生産・営業に対し監督検査を行なう際、以下の措置を採る権利を有する: (一)生産・営業場所に入り現場検査を実施する。 (二)生産・営業する化粧品に対しサンプリング検査をおこなう。 (三)関連契約・帳票・帳簿・その他の関連資料を閲覧・複製する。 (四)強制性国家基準・技術規範に適合しない、或いは人体の健康を害する可能性があると証明されている化粧品及びその原料・直接化粧品と接触する包装材料、並びに違法な生産・営業に使用されることが証明されている工具・設備を差し押さえる。 (五)違法に生産・営業活動に従事している場所を差し押さえる。 | 今後は海外の製造元にも現地視察に出向く話もあり。 |
| <77条> 歯磨き粉は本条例の普通化粧品に関する規定に照らして管理を行う。歯磨き粉の備案者は国家基準・業界基準に照らして効能の評価をおこなった後、歯磨き粉の有する虫歯予防・プラーク抑制・知覚過敏抑制・歯肉退縮の軽減等の効能を標榜することができる。歯磨き粉の具体的な管理方法は国務院薬品監督管理部門により制定され、国務院市場監督管理部門により審査・承認され、発布される。 石鹸には本条例は適用されないが、特殊化粧品の効能を有すると標榜するものに関しては本条例を適用する。 | 歯磨き粉は、従来は事前の申請手続き不要だった。 石鹸は、スキンケア目的の場合は化粧品に該当していた。 |
| 本条例の施行前に既に登録され、育毛・脱毛・美乳・健康美容・除臭に用いる化粧品については本条例の施行日より起算して5年間の過渡期を設け、過渡期内は継続して生産・輸入・販売してよいが、過渡期満了後は当該化粧品を生産・輸入・販売してはならない。 | 育毛・脱毛・美乳・美容健康・除臭に用いられる化粧品は特殊化粧品の扱いだった。 |
よくあるご質問
- 以前CFDA登録した製品があるが、更新できるか?
-
CFDA時代のものは更新手続きを行うことはできません。
有効期限内であれば、一旦取り消し手続きを行なってから新規NMPA手続きを行います。 - 製品中に中国で使用できない原料が含まれている。ウリの原料なので抜きたくないがどうすればいいか?
-
禁止原料の場合は使用不可です。新原料の場合は原料メーカー様へお願いして「新原料申請/ 備案
(登記)」手続きを行う必要があります。 - 中国ではどのような原料を使用すると「美白化粧品」として扱われるのか?
-
正式に発表されていませんが、一般的に日本で美白効能が認められている原料は中国でも美白効能があると認識されています。
また、美白成分を使用した時点で「美白製品」として認定されるわけではなく、美白効果の“人体効能評価試験”で効果で美白効能の根拠を示す必要があります。 - 動物実験を行わずNMPA手続きを行うことは可能か?
-
特殊化粧品の場合は、現時点で回避方法がありません。
普通化粧品の場合は方法がありますので、ご依頼時に動物実験回避の旨をお知らせください。 - 処方を開示したくない。配合比率を開示せずNMPA手続きを行うことは可能か?
-
できません。NMPA手続きでは成分表を提出する必要があり、プレミックス原料の「INCI名」「配合量」「配合目的」を申告します。 配合比率は幅のある記載が認められていないため注意が必要です。
また、水以外の全原料の「原料メーカー名」「原料製品名」を含む“原料安全関連情報”の提出が必要です。 - 「原料登録」とは何か?
-
Q5.の“原料安全関連情報”をNMPAシステムへ事前登録することです。
登録すると「原料伝達コード」が発行され、化粧品会社が化粧品のNMPA手続きを行う際に、当該コード
のみ申告することで認められるようになります。
原料登録をご希望の際はお問合せください。 - ヒト幹細胞成分を化粧品に使用する方法はあるか?
-
非常に人気の成分ですが、中国ではヒト由来原料を禁止していますので使用できません。
- 「品質安全責任者」の該当者がいない場合、どうすれば良いか?
-
「NMPA申請者/備案者」「委託製造会社」からそれぞれ品質安全責任者を申告する必要があります。
(自社生産の場合は前者からのみ)
「NMPA申請者/備案者」「委託製造会社」がグループ企業であれば1名のみの申告で足りるケースが
ありますが、基本的には両社から申告が必要です。 - NMPA許可を取得した製品の処方変更が生じた。原料変更は可能か?
-
基本的に処方変更は認められません。
新条例では、実質的な変更がない場合(成分の種類・配合比率等)の原料メーカーの変更手続きが可能と
されています。また、主要効能成分に変更がなく、微量な安定剤・抗酸化剤・防腐剤等の種類もしくは
含有量の変更の場合も変更手続きが可能とされていますが、厳しい審査が行われることとされており、
容易には認められないと考えられます。
中国食品薬品検定研究院によるFAQ
Comming Soon ….
提案書一覧
化粧品NMPA申請
提案書
化粧品原料品質安全関連情報
登録代行サービス提案書
化粧品NMPA新原料申請
提案書












