中国化粧品原料品質安全関連情報の提出制度について
中国化粧品原料品質安全関連情報とは
新条例に基づく申請では、化粧品NMPA申請時に水(WATER)以外の全ての成分について「原料品質安全情報文書」を化粧品原料メーカーが作成し、NMPA申請者がデータベースにアップロードすることが要求されています。
この「原料品質安全情報文書」を事前に化粧品原料メーカーが登録した場合、NMPA申請者は登録された原料コード(直訳では「原料伝達コード」)を引用して申請を行う事ができ、申請時の工数を削減できるというものです。
中国化粧品原料品質安全関連情報に関連する規定一覧
化粧品登録登記申請資料管理規定 (中文:化妆品注册备案资料管理规定)
- 第三章 登録と登記の資料要求 第26条(三)(内容:登録登記者への資料要求、製品配合の資料提出義務)… P3
- 同章 第29条(二)(内容:製品配合に対する要件、原料メーカー情報並びに、品質安全情報の提出義務)… P3
- 添付資料11 配合表の雛形 … P4
- 添付資料12 化粧品原料品質安全関連情報伝達ガイドライン(内容:原料の安全関連情報提出に関するガイドライン)… P5
- 添付資料13 原料品質安全関連情報登記企業情報表(内容:原料メーカー企業情報提出の雛形)… P6
- 添付資料14 原料品質安全関連情報(内容:原料の品質安全関連情報提出の雛形)… P7-8
化粧品登録登記資料管理規定の関連項目に関する公告
(中文:国家药监局关于实施《化妆品注册备案资料管理规定》有关事项的公告 )
- 化粧品原料の安全性に関する情報の提出(内容:既存登録済み製品等の全成分の安全情報の提出に関する経過措置)… P9
中国化粧品原料品質安全関連情報 関連法規 化粧品登録登記申請資料管理規定
(中文:化妆品注册备案资料管理规定)
第三章 登録と登記の資料要求
- 第26条 登録者が登録申請或いは登記者が登記手続きをする際には、以下の資料を提出しなければならない。
- (一)《化粧品登録・登記情報表》及び関連資料。
- (二)製品名称の情報
- (三)製品配合
- (四)製品執行基準
- (五)製品ラベルの詳細稿
- (六)製品検査報告
- (七)製品安全評価資料
- 第29条 (二)登録・登記者/国内責任者は製品使用原料の生産業者情報を記載し、原料生産業者が発行する原料品質安全情報文書をアップロードしなければならない。
原料生産業者が既に《化粧品原料品質安全関連情報伝達指南》(添付資料12及び添付資料13)に基づき原料品質安全関連情報を提出した場合は、登録・登記者/国内責任者は原料品質安全情報文書に原料報告コード(添付資料14)を記入することができる。
- 第26条で化粧品の製品登録(特殊化粧品)、登記(普通化粧品)を申請する場合の資料要求が明示されました。その中の一つに、製品配合(複合成分表)がある。(旧条例でも同様の要求がありました)
- 第29条で、化粧品の製品登録(特殊化粧品)、登記(普通化粧品)を申請する場合の原料に関する資料要求が明示されました。資料要求の対象となる成分は水以外の全ての原料です。(後述:添付資料12 化粧品原料品質安全関連情報伝達ガイドライン)
- 原料品質安全情報文書は、原料メーカーが作成。作成した文書を申請者経由でアップロードする方法と、もう一つの方法として、事前に原料データベースに原料メーカーが登録しておけば、申請時に文書は必要なく原料報告コードをもって申請することができると規定された。
添付資料11 配合表の雛形
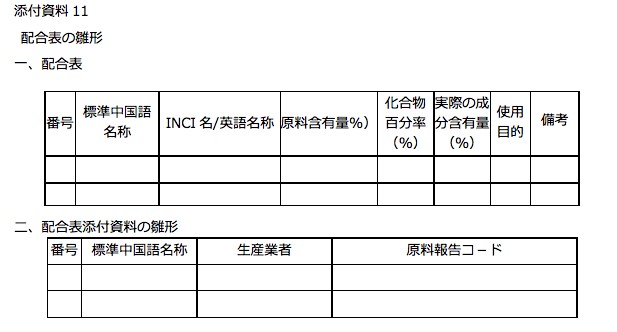
- 管理規定の添付資料11は、申請時提出用の「配合表の雛形」です。
- 配合表添付資料の雛形の赤枠部分に「原料報告コード」を記載する欄がある。
- 原料品質安全情報文書は、原料メーカーが作成。作成した文書を申請者経由でアップロードする方法と、もう一つの方法として、事前に原料データベースに原料メーカーが安全情報を登録しておけば、申請時に文書は必要なく、原料報告コードをもって申請することができると規定された。
添付資料12 化粧品原料品質安全関連情報伝達ガイドライン
- 化粧品原料メーカーとは、原材料の安全に責任を持つ企業で、原材料の実際の製造会社、実際の製造会社と同じグループの企業に属する関連会社の場合があり、原材料、または原材料の生産を委託する委託会社を指す。化粧品原料生産業者は、国家薬品監督管理局の原料安全情報サービスプラットフォームを介して《原料品質安全関連情報提出企業情報表》(添付資料13)及び企業主体証明文書を提出し、化粧品原料品質安全関連情報の提出権限を登録しなければならない。
- 領土外または国内の原材料メーカーは、化粧品原材料の安全性情報を自社で提出することも、領土外または国内の法人に原材料の安全性情報の報告および維持を許可することもできる。 原料生産業者はその他の領土内企業に授権を行い原料品質安全関連情報に関しての提出及び日常的な維持管理をおこなわせることができ、被授権企業がユーザー権限を登録する時には、同時に化粧品原料生産業者の発行する授権書を提出しなければならない。授権書には授権関係及び原料品質安全関連情報の伝達を授権した原料商品名称を明記し、同一規格の原料の品質安全関連情報については、単一の企業にのみ授権できるものとする。
- 原料品質安全関連情報には原料商品名・原料基本情報・原料生産工程の概要・必要な品質管理要件・国際的に権威のある機構による評価結論・その他の業界の使用要件・リスク物質限度量の要件等を含めなければならず、詳細は添付資料14を参照するものとする。化粧品の生産に水を使用した場合は原料品質安全関連情報の提出は必要ないが、特殊な産地に由来する水の場合はその限りではない。
- 管理規定の添付資料12では、「化粧品原料品質安全関連情報」についての具体的な規定が記載されている。
- 原材料メーカーは《原料品質安全関連情報提出企業情報表》(添付資料13)を提出、原料メーカーの資格証明にあたる文書を提出する。
- 原材料メーカーは化粧品原材料の安全情報を「自社で提出」、もしくは「申請代行会社(被授権会社)」を通じて提出、登録済情報の維
- 持管理を行う。
- 1つの原材料の品質安全情報は1つの被授権会社に限って授権できる。
- 原材料の品質安全情報は添付資料14を参照する。
添付資料13 原料品質安全関連情報登記企業情報表
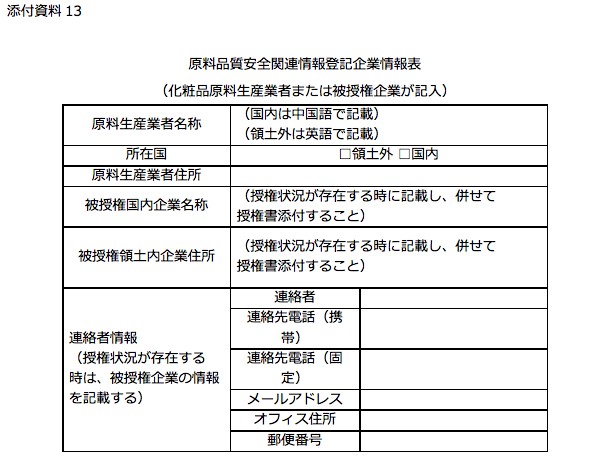
- 管理規定の添付資料13では、原料メーカーの情報を記載すると併せて中国国内に授権先がいる場合被授権者情報を記載する。
- 授権をしていない場合は、原料メーカーの日本国内の連絡先等を記載する。
添付資料14 原料品質安全関連情報【基本情報】
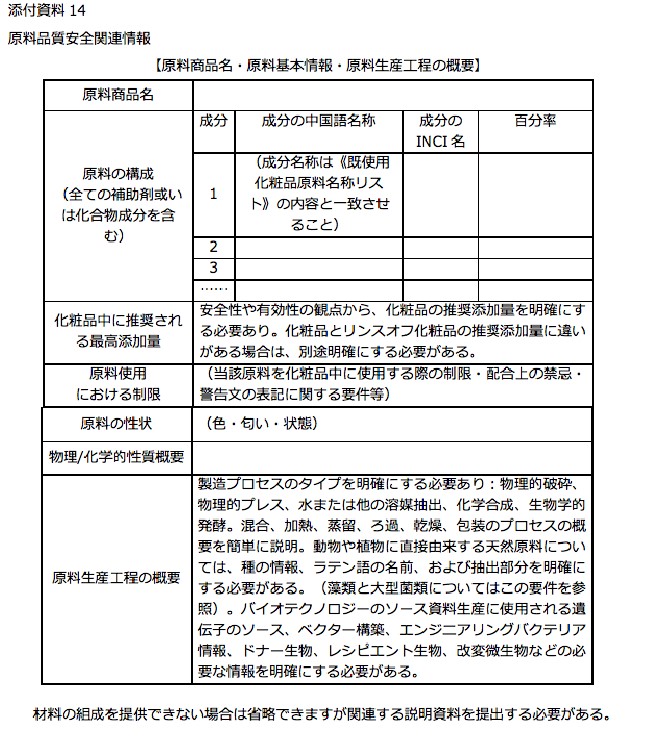
- 管理規定の添付資料14では原料の安全情報を、基本情報・生産工程・品質管理情報を記載について記載する。
- 旧条例下ではここまでの情報を提供する必要はなく、新条例施行後に大幅な情報提供が要求された。
- 安全関連情報は、原料メーカーが作成し、申請会社を通じてNMPA局に提出するか、もしくは原料メーカーが事前に原料DBに登録し原料報告番号をもって申請会社が申請する方法がある。
添付資料14 原料品質安全関連情報 【品質管理要件】
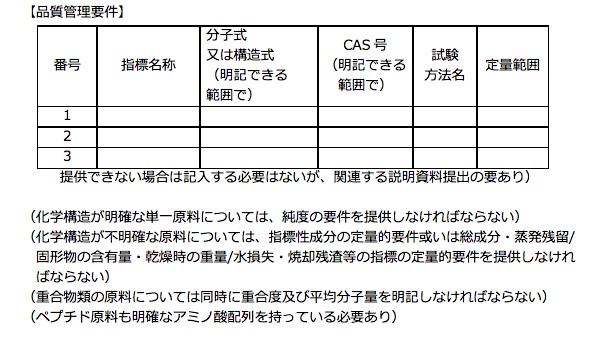
管理規定の添付資料14の【品質管理要件】では当該成分の安全管理指標が中国国家標準に基づいているか等の基本的なチェックが必要でになると考えられます。
化粧品登録登記資料管理規定の関連項目に関する公告
化粧品原料の安全性に関する情報の提出
- 2021年5月1日以降、登録登記を申請する際は、登録者登記者は、製品処方原料の出所および製品名情報を記入する必要がある。
- 「化粧品安全技術規範」に品質仕様がある原材料が含まれる場合は、原材料の品質仕様書または安全関連情報も提出する必要がある。
- 2022年1月1日以降、登録登記人が登録を申請するとき、または登記する際、防腐、日焼け止め、着色、染毛、シミ除去、美白効能を備えた原材料の安全関連情報は、「規定」の要件に従って提出するものとする。
- 2023年1月1日以降、登録登記人が登録を申請するとき、または登記する際は、「規定」の要件に従って、全ての原材料の安全関連情報を提供するものとする。
- 以前に登録または登記完了した化粧品の登録登記者は2023年5月1日までに製品処方の全ての原材料の安全関連情報を提供、補充するものとする。
3月5日に国家薬品監督管理局(NMPA局)が公表した、新条例に基づく実務規定の経過措置には、「化粧品原料の安全性に関する情報の提出」の記載があります。
- 2021年5月以降:原料メーカーの基本情報と一部の原料について安全関連情報の提出が求められる。
- 2022年1月以降:特殊化粧品効能にあたる原材料は安全関連情報(添付資料14)の提出が必要。
- 2323年1月以降:新しい登録・登記申請においては、全ての原料について安全関連情報(添付資料14)の提出が必要。
- 2023年5月以降:全ての化粧品製品(登録・登記済製品を含む)について全ての原料について安全関連情報(添付資料14)の提出が必要。 ※ CFDA登録済み製品や、2023年5月以前にNMPA申請した製品等、全ての製品が対象。
化粧品原料品質安全関連情報の公開について
先行実施されている類似制度から先行実施されている類似制度
医薬品調達事項改善のための審査承認およびその管理作業に関する事項の報告書(2019年第56号)
新条例では、化粧品の品質安全管理の精度を高めることが一つの目標です。
しかし、全ての化粧品原材料成分について毎回の申請で審査を行うことは容易ではなく、原料の事前登録制度は、NMPA化粧品申請時の審査工数の削減を狙ったものと思われます。
この制度の狙いとシステム的に類似している制度は、NMPA局より2019年8月15日に施行された「国家医薬品管理局によるさらなる医薬品調達事項改善のための審査承認およびその管理作業に関する事項の報告書(2019年第56号)」です。
56号公告では、医薬品メーカーが中国で医薬品製剤の申請を行う際に、医薬品製剤に関連する医薬品原料、医薬品添加剤、医薬品包材(薬包材等)について、事前に薬包材等を生産する企業に登記を要求しています。
この制度では、医薬品製剤申請者が関連する薬包材等については事前に登記された登記号を参照することで、審査工数の削減、審査の迅速化が図られています。この制度では、強く事前登記が推奨されており、制度の本文では「特殊な理由により登記することができない場合」を除き、登記号を参照して申請することを義務付けています。
今後、化粧品原料の事前登録制度も医薬製剤申請同様、原料の事前登録を強く推奨、将来的には義務化していく可能性が高いと考えられます。
この制度における情報公開レベルについては以下の通りです。
- データベース上で原料名称等の基本情報は検索でき、一般的な企業情報だけが公開されます。
- 登録された薬包材等を使用する医薬品メーカーは、登録者からデータベースの登記番号を引用する授権を得て申請します。その際、医薬品メーカーは登録された情報の詳細を確認することができます。
制度利用のポイント
- 原料を事前登録すれば、申請者を通じて安全情報を提供する必要はありません。(原料報告番号を引用すればよい)
- 56号公告を参考に考えれば、原料を事前登録していても申請者、少なくとも中国国内の責任会社は詳細情報を確認することが可能です。
- しかし、責任会社との間で守秘義務契約を締結することで、日本の申請会社等に対する詳細な情報開示を行わない方法も考えられます。
- ※ 中国の責任会社は申請する化粧品の品質責任や申請内容に責任を負うため、責任会社への情報開示は不可欠です。
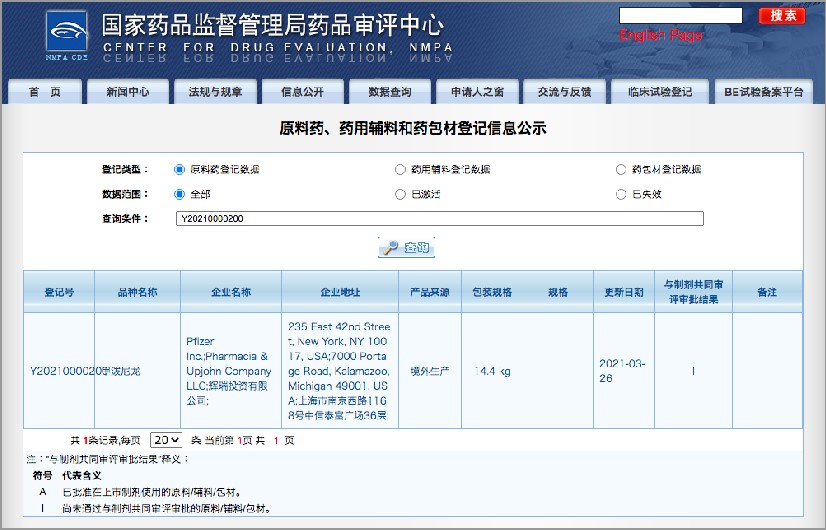
情報公開の内容は以下の通りです。
- 登記号
- 製品名称
- 製品製造メーカー名称
- 製品製造企業住所
- 製産由来情報(国内外等)
- 包装規格
- 製品規格
- 登録日
- 使用状態(薬事申請での採用状況)
化粧品原料品質安全関連情報の提出制度のポイント
NMPA化粧品申請で新設された化粧品原料に関する当該規定のポイントは3点です。
- ① 水以外の全ての原料の品質安全情報が要求されます。(経過措置)
- 2023年1月1日以降、登録登記人が登録を申請するとき、または登記する際は、「規定」の要件に従って、全ての原材料の安全関連情報を提供するものとする。
- 以前に登録または登記完了した化粧品の登録登記者は2023年5月1日までに製品処方の全ての原材料の安全関連情報を提供、補充するものとする。
- ② 品質安全情報は事前に原料メーカーが登録をすることで自動的に付与される「原料コード(原料報告コード)」を記入することで代替できる。
- ※ 原料の詳細情報をどこまで制限できるか、その手法と公開システムの確認が必要。
- ③ 原料メーカーは事前の登録とその後の管理を中国国内の企業に委託することが可能。
- ※ 当該メーカーが生産している1つの原料を複数の企業に委託することはできない。
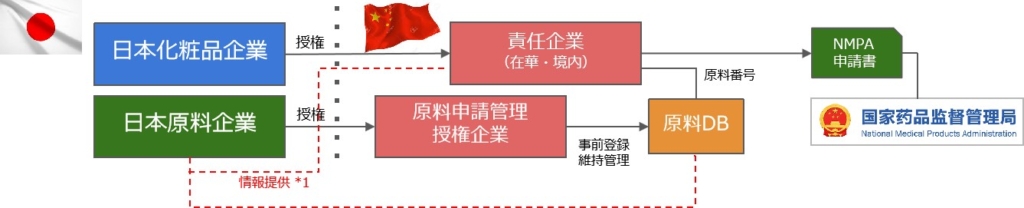
*1:品質安全情報を日本企業を通じて登録する方法
*2:中国のDBに直接登録する方法
化粧品原料品質安全関連情報の提出・維持管理サービス
WWIPの提供するサービス
原料メーカーの授権を得て事前登録を代行する業務、並びに維持管理(NMPA局に対する報告やメンテナンス等)を提供する業務。
- 原料データベース管理:株式会社ワールドワイド・アイピー・コンサルティングジャパン(WWIP: 東京都港区西新橋1-20-10)
- 所要期間 :授権〜登録まで2ヶ月と想定されます。
WWIPの提供するサービスのポイント
- 原料の事前登録を行うことで、NMPA化粧品申請を行う日本企業から、成分についてまちまちな要求がきて都度要求にあわせて資料を作成、提出するといった煩雑な対応がなくなります。また、NMPA化粧品申請企業にとっては、成分の安全性評価に関する工数が削減され迅速な申請につながります。
- 中国で使用実績がある成分についての登録であるため、比較的簡易な申請登録であると予想されますが、申請資料はすべて中国語で翻訳し、当該成分の安全管理指標が中国国家標準に基づいているか等のチェックが必要であり、そうした業務をWWIPが一括して行います。
- 化粧品監督管理条例・化粧品登録/登記管理辯法・化粧品安全技術規範、及びその他の中華人民共和国の化粧品監督管理関連法規の要件及び技術要件に適合することの確認が必要です。
- 登録前に、関連資料の公証・複写、登録に必要な関連情報の確認・検証を行います。
- 登録された原料の原料番号等の情報提供や、申請に伴うご質問等、日本企業への問合せの対応も可能です。
- 登録された原料は中国のデータベースに掲載、検索等が可能になるため中国企業がデータベースを検索し、OEMの問合せ等をしてくる可能性があります。そうした場合の中国からの問合せ対応が可能です。
日本企業が提出する必要がある資料一覧
- 基本情報
- 原料の商品名、INCI名、中国語翻訳名、CAS登記番号、EINECS/ELINCS 登記番号
- 化学名称、化学構造式
- 原料の構成
- 化学構造が明確な単一原料の場合:純度/含有量の条件
- 化学構造が不明確な原料の場合:指標性成分の定量的要件或いは総成分・蒸発残留・固形物の含有量・乾燥時の重量/水損失・焼却残渣等の指標の定量的要件
- 重合物の原料の場合:重合度、平均分子量
- 原料の由来
- 原料由来を表記
- 動植物由来の場合
- 動植物原料名称(学名(ラテン語))
- 種の情報
- 抽出部分(部位)
- 性状及び物理/化学的性質
- 色、匂い、状態
- 物理/化学的性質の概要
- 技術要件
- 原料の使用目的
- 原料の適用範囲
- 原料の生産工程
- 製造プロセスのタイプを明確にする必要あり:物理的破砕、物理的プレス、水または他の溶媒抽出、化学合成、生物学的発酵。混合、加熱、蒸留、ろ過、乾燥、包装のプロセスの概要を簡単に説明。動物や植物に直接由来する天然原料については、種の情報、ラテン語の名前、および抽出部分を明確にする必要がある。(藻類と大型菌類についてはこの要件を参照)。バイオテクノロジーのソース資料生産に使用される遺伝子のソース、ベクター構築、エンジニアリングバクテリア情報、ドナー生物、レシピエント生物、改変微生物などの必要な情報を明確にする必要がある。
- 安全使用量の要件
- 化粧品中の最大使用量/ leave on
- 化粧品中の最大使用量/ rinse off
- その他の安全性の要件(原料使用における制限)
- 当該原料を化粧品中に使用する際の制限・配合上の禁忌・警告文の表記に関する要件等
- 品質管理基準
- 品質管理要件
- 化学構造が明確な単一原料については、純度の要件を提供しなければならない。
- 化学構造が不明確な原料については、指標性成分の定量的要件或いは総成分・蒸発残留/
- 固形物の含有量・乾燥時の重量/水損失・焼却残渣等の指標の定量的要件を提供しなければならない。
- 重合物類の原料については同時に重合度及び平均分子量を明記しなければならない。
- ペプチド原料も明確なアミノ酸配列を持っている必要あり。
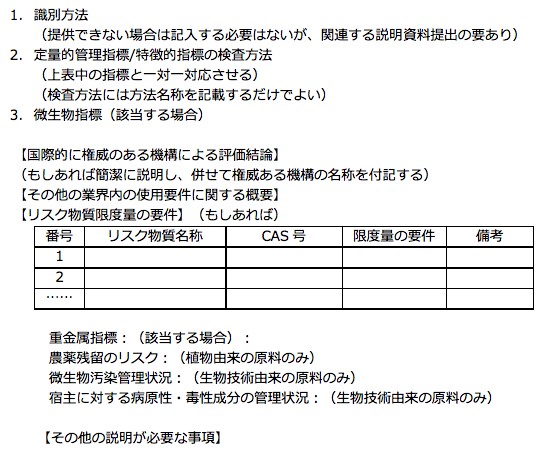
- 識別方法 : 提供できない場合は記入する必要はないが、関連する説明資料提出の要あり。
- 定量的管理指標/特徴的指標の検査方法(表中の指標と一対一対応させる / 検査方法には方法名称を記載するだけでよい)
- 微生物指標(該当する場合)
- 安全性リスク物質及びその管理基準
- 微生物(生物技術由来の原料のみ)、重金属(該当する場合)、有害物質やその他の管理指標など
- 農薬残留(植物由来の原料のみ)
- 品質管理要件
- その他の要件
- 保管存条件
- 品質保証期間
- その他、業界内の使用要件に関する概要
- 効能の根拠
- 効能根拠資料は、一般的に科学文献、法規資料、実験室研究データ、人体効能性評価試験データなどを含む。
- 最終的に申請資料として要求されない可能性があります。
- 国際的に権威の有る機関による安全性評価結論
- 世界保健機構(WHO)・国連食糧農業機関(FAO)・EU消費者安全科学委員会(SCCS)・米国化粧品成分審査委員会(CIR)等の国内外の権威ある機構が既に公布している化粧品の安全な使用に関する結論・許容一日摂取量・耐容一日摂取量・参照用量・一般に安全とされる物質(GRAS)等の安全限度量或いは結論
WWIPの提供するサービス関連費用
| サービスの内容 | 費用(税別) | 備考 |
|---|---|---|
| 申請必要データに関する過不足等の事前簡易チェック | 無料 | 現状有しているデータが申請要求を満たすかの簡易チェックを行います。 |
| 原料品質安全関連情報 申請・登記業務 | ||
| 申請に関する授権費用 | 35,000円/1社 | ・アカウント作成に必要な企業主体証明(現在事項証明書)を取得し、外務省公印申請、領事認証手続き、翻訳資料作成致します。 ・授権書について、別途公証認証手続きが必要となります。弊社で代行して手続きを行う場合に別途費用が発生致します。 |
| 原料登録数ごとの申請代行費用 1-10 11-30 31-50 51-100 100- | 40,000円/1原料 35,000円/1原料 30,000円/1原料 25,000円/1原料 応談 | 申請業務の内容 1. 原料データの登記委託権限の開通 2. 原料申請様データ表の記入(中文) 3. 原料データが申請要件を満たしているかのチェック 4. 原料データベースへの登記 5. 原料伝達コード取得 |
| 国際的な権威ある機関の安全性評価結論の調査 ※ご依頼があった場合のみ発生します。 | 35,000円/1評価 | 安全性評価のエビデンスが必要な場合で、貴社で 用意ができない場合、WHO,FAO,SCCS,CIR等の 国際的な権威ある期間が公表している文書を検索し、 該当する資料を用意します。 ※公表文書がなかった場合は、検索費用として10,000円をご請求します。 |
| 申請資料の翻訳費用 | 20,000円/1製品 | (例)A4、1ページ日本語400文字 又は英文300WORDとして=20,000円 |
| 年間維持管理費用 | 不要 | 年間報告義務が生じた場合、費用が発生する可能性があります。 |
※ 原料データベース開通後間もないため、今後の実務で工数が予想以上に増大するなどした場合、費用が変更となる可能性があります。
※ 登録が出来なかった場合、費用は発生しません。












