新・化粧品監督管理条例に基づく新化粧品原料申請について
2020年8月28日に中国化粧品安全技術評価センターが発表した「化粧品新原料の登録および登記規範」(意見募集稿)の公開請求通知」に基づき、2020年9月15日よりNMPA化粧品新原料申請業務の受託を開始いたしました。

提供するサービス
新原料申請が可能な原料であるか、実行可能性に対して検討・報告を行う
新原料申請が可能である場合、製造企業が有する各種検査結果データ等の資料が登録要求を満たしているかに対して検討・報告を行う
新原料をNMPA局に申請する業務。(資料作成、中文翻訳等、申請に必要となる業務一切を含む)
新原料登録後から3年間のサマリーレポート提出義務期間における対応
※ 申請までの(1)~(3)のステップで早くて3~4ヶ月かかります。早期に申請のご検討をお勧めいたします。
また、本サービスに関する一部の参照や根拠は推測を含めて整理したもので、実際の申請制度については中国行政当局の発表を待つ必要があります。
新・化粧品監督管理条例における新原料申請関連条文
第二章 原料と製品
第十一条
本国の領土内で初めて化粧品に使用する天然或いは人工の原料を化粧品新原料と言う。
防腐・紫外線保護・着色・染髪・シミ取り・美白効果を有する化粧品新原料は、国務院薬品監督管理部門を通じて登録完了後に使用することができる;その他の化粧品新原料は、使用前に国務院薬品監督管理部門に対し備案をしなければならない。
国務院薬品監督管理部門は科学研究の発展に基づき、登録管理をおこなう化粧品新原料の範囲を調整し、国務院の承認後にそれを実施することができる。
第十二条
化粧品新原料の登録を申請する或いは化粧品新原料の備案をおこなう際には以下の資料を提出しなければならない:
- 登録申請者・備案者の氏名・住所・連絡先;
- 新原料の研究開発報告;
- 新原料の製造準備工程・安定性及びその品質管理基準等の研究資料;
- 新原料の安全性評価資料。
登録申請者・備案者は提出資料の真実性・科学性に対し責任を負わなければならない。
第十三条
国務院薬品監督管理部門は化粧品新原料登録申請を受理した日から起算して3営業日以内に申請資料を技術審査機構に渡さなければならない。
技術審査機構は申請資料を受け取った日から起算して90営業日以内に技術審査を完了し、国務院薬品監督管理部門に対し審査意見を提出しなければならない。国務院薬品監督管理部門は審査意見を受け取った日から起算して20営業日以内に決定をしなければならない。要件に合致しているものに対しては、登録をおこなった上で化粧品新原料登録証を発行する;要件に合致していないものに対しては、登録をおこなわず書面による理由の説明をおこなう。
化粧品新原料の備案者が国務院薬品監督管理部門のオンライン政務サービスプラットフォームを通じて本条例に規定される備案資料を提出すると、備案は即時完了する。
国務院薬品監督管理部門は、化粧品新原料の承認・登録の日、或いは備案者が備案資料を提出した日より起算して5営業日以内に登録・備案に関する情報を公表しなければならない。
第十四条
登録・備案を経て化粧品新原料の使用を開始して以降3年間は毎年、新原料登録者・備案者は国務院薬品監督管理部門に対し新原料の使用及び安全状況について報告をしなければならない。
安全上の問題が存在する化粧品新原料に対しては、国務院薬品監督管理部門が登録或いは備案の取消しをおこなう。
3年の期間が満了するまで安全上の問題が発生していない化粧品新原料については、国務院薬品監督管理部門が制定する既使用化粧品原料のリストに追加される。
登録・備案を経た化粧品新原料が既使用化粧品原料のリストに追加される迄は、依然として化粧品新原料の規定に基づき管理される。
第十五条
化粧品の生産に用いることが禁止されている原料のリストは国務院薬品監督管理部門により制定・公布される。
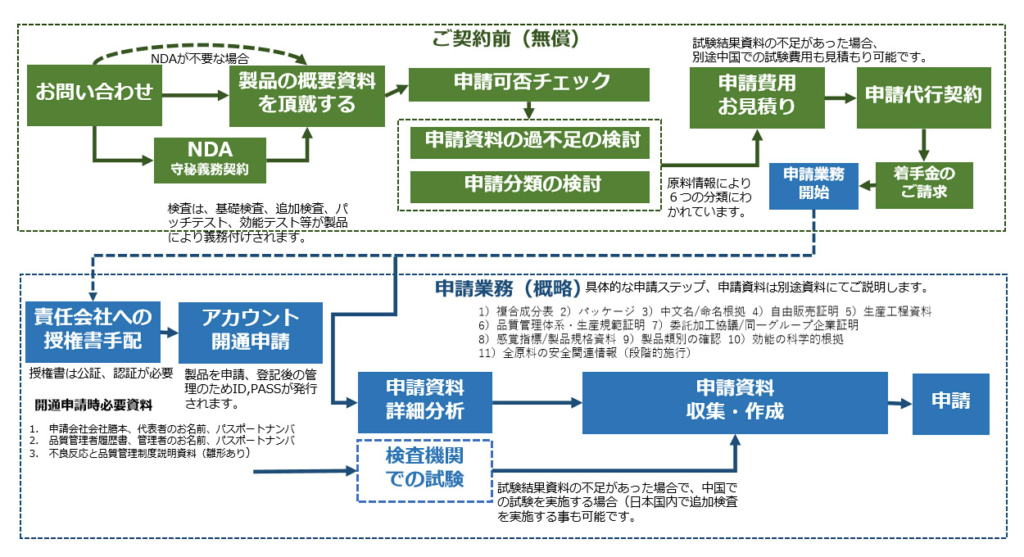
化粧品新原料申請手続きと申請代行費用
- 化粧品監督管理条例(2020.06.29公布/2021.01.01施行)
- 化粧品登録登記管理弁法(2021.01.07公布/2021.05.01施行)
- 化粧品登録登記管理弁法(2021.01.07公布/2021.05.01施行)
- 化粧品安全評価技術ガイドライン(2021.04.09公布/2021.05.01施行)
- 化粧品登録提出資料提出技術指南(試行)(2021.04.25公布/2021.05.01施行)
中国化粧品新原料NMPA申請の一般的な進め方
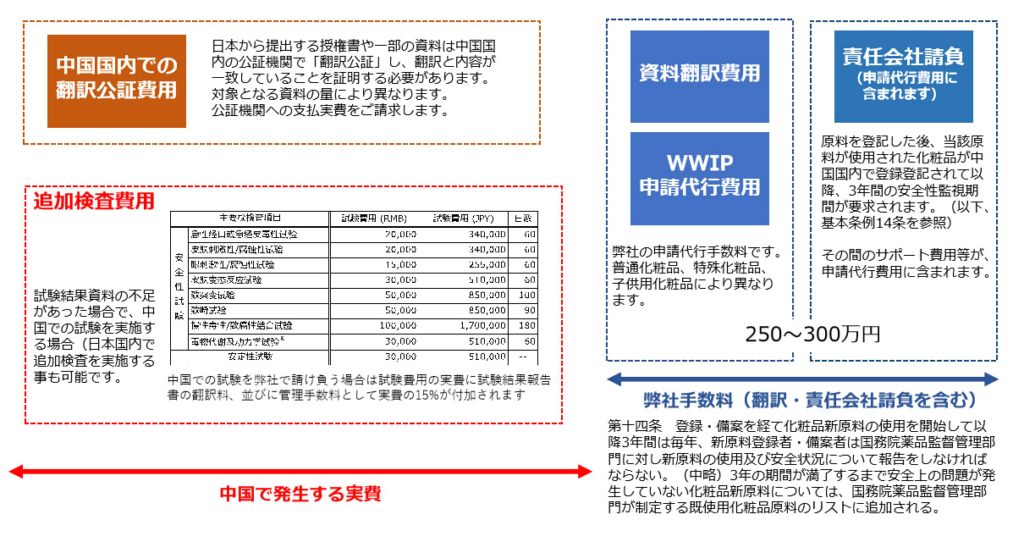
- 新条例施行に伴う料金 2021.05〜からの適用になります
中国化粧品新原料NMPA申請費用
- 税別料金になります
資料:化粧品新原料の申請及び審査に関する指南
本指南は化粧品新原料の申請及び審査に関する指導に用いられる。
一、化粧品新原料の定義
化粧品新原料とは、国内で初めて化粧品の生産に使用される天然或いは人工の原料を指す。
二、化粧品新原料の安全性に関する要件
化粧品新原料は正常で且つ合理的・予測可能な使用条件下で、人体の健康に危害を及ぼしてはならない。
化粧品新原料の毒性学的評価資料には、毒性学的安全性評価のまとめ・必要な毒性学的試験資料・安全性に関するリスクが存在する可能性のある物質の安全性に関する評価資料を含まなければならない。
化粧品新原料には、一般に以下の毒性学的試験を行なう必要がある。
- 急性経口毒性試験及び急性経皮毒性試験;
- 皮膚刺激性/腐蝕性試験及び急性眼刺激性/腐蝕性試験;
- 皮膚感作性試験;
- 皮膚光毒性試験及び皮膚光線過敏試験(原料が紫外線吸収特性を有する際に当該試験を実施する必要がある)
- 突然変異試験(少なくとも遺伝子突然変異試験及び染色体異常試験を一項目ずつ含むこと);
- 亜慢性経口毒性試験及び亜慢性経皮毒性試験;
- 催奇形性試験;
- 慢性毒性/癌原性併合試験;
- 毒物動態試験及び毒物動力学試験;
- 原料の特性及び用途に基づき必要とされるその他の試験。
もし当該新原料と既に化粧品に使用されている原料の化学構造及び特性が類似している場合は、いくつかの試験を省略することを考慮しても良い。
本指南で規定する毒性学的試験資料は原則的な要件であり、原料の物理/化学的性質・定量的構造活性相関・毒性学資料・臨床研究・人工疫学調査・類似化合物の毒性等の資料の状況に基づき、試験項目を追加したり省略したりすることができる。
三、化粧品新原料の行政許可申請資料の要件
化粧品新原料の行政許可申請においては、化粧品行政許可申請受理規定に照らして資料を提出しなければならない。具体的要件は以下の通り:
- 化粧品新原料の行政許可申請表
- 研究開発報告書
- 原料の研究開発の背景・過程・関連する技術資料。
- 原料の名称・由来・相対分子質量・分子式・化学構造・物理/化学的性質。
- 名称: 原料の化学名(IUPAC名及び/或いはCAS名)・INCI名及びその中国語翻訳名・商品名及びCAS番号等。原料の名称については、同時に当該原料の使用規格も明記しなければならない。
天然原料はラテン語の学名も表記しなければならない。 - 由来: 原料は混合物となってはならないが、技術的要因により取り除くことのできない溶剤・安定剤・担体等は含まない。
天然原料の由来は単一でなければならず、使用部位等を記載しなければならない。植物全体が既に化粧品原料に用いることを許可されている場合は、当該植物の各部位を新原料として改めて申請する必要はない。 - 相対分子質量・分子式・化学構造:化学構造を確認した根拠となる解析方法(例:核磁気共鳴スペクトル・元素分析・質量分析・赤外線スペクトル等)及びその解析結果を提供しなければならず、重合体についてはさらに相対平均分子質量及びその分布を提供しなければならない。
- 物理/科学的性質: 色・匂い・状態・溶解度・融点・沸点・比重・蒸気圧・pH値・pKa値・屈折率・旋光度等。
- 名称: 原料の化学名(IUPAC名及び/或いはCAS名)・INCI名及びその中国語翻訳名・商品名及びCAS番号等。原料の名称については、同時に当該原料の使用規格も明記しなければならない。
- 原料を化粧品中に使用する目的・使用範囲・安全に使用するための限度量及びその根拠・注意事項・警告等。
- 原料が国外(地域)で化粧品に使用されているか否かに関する状況説明等。
- 生産工程の概要及び簡略図
化粧品新原料の生産過程における主要工程・フロー・パラメータを説明しなければならない。例えば、原料・反応条件(温度・圧力等)・補助剤(触媒・安定剤等)・中間生成物・副産物・生産準備手順等を含む;もし天然の抽出物である場合は、加工/抽出方法・抽出条件・使用溶剤・残留する可能性のある不純物或いは溶剤等を説明しなければならない。 - 原料の品質安全管理に関する要件
規格・検査測定方法・存在する可能性のあるリスクとなる物質及びその管理措置等の内容を含めなければならない。- 規格: 純度或いは含有量・不純物の種類及びその各含有量(重合体については残留モノマー及びその含有量)等の品質安全管理指標、技術的要因により原料中から取り除くことのできない溶剤・安定剤・担体等の種類及び各含有量、その他の物理/化学的パラメータ、品質保証期間、貯蔵条件等を含める;もし天然植物の抽出物である場合は、その品質安全管理指標を明確にしなければならない。
- 検査測定方法: 原料の定性的/定量的検査測定方法・不純物の検査測定方法等。
- 存在する可能性のあるリスクとなる物質及びその管理措置。
- 性学的安全性評価資料(原料中の安全性に関するリスクが存在する可能性のある物質の安全性に関する評価資料を含む)
毒性学的試験の資料は、申請者の試験資料、科学文献資料、国内外の政府公式ウェブサイト・国際組織のウェブサイト上で発布された内容のいずれでも良い。- 化粧品新原料の申請では、一般に化粧品新原料の安全性要件に応じて毒性学的試験の資料を提出しなければならない。
- 以下の状況を含む場合は、以下の規定に照らして毒性学的試験の資料を提出することができる。原料の特性及び用途に基づき、必要な場合は、関連する試験資料の追加或いは省略を求めることができる。
- 防腐剤・紫外線保護剤・着色剤・染髪剤の機能のいずれも有さない原料及び安全性の面から《化粧品衛生規範》の使用制限物質のリストに含む必要がないと考えられる化粧品新原料に関しては、以下の資料を提出しなければならない:
- 急性経口毒性試験及び急性経皮毒性試験;
- 皮膚刺激性/腐蝕性試験及び急性眼刺激性/腐蝕性試験;
- 皮膚感作性試験;
- 皮膚光毒性試験及び皮膚光線過敏試験(原料が紫外線吸収特性を有する際に当該二項目の試験を実施する必要がある);
- 突然変異試験(少なくとも遺伝子突然変異試験及び染色体異常試験を一項目ずつ含むこと);
- 亜慢性経口毒性試験或いは亜慢性経皮毒性試験。もし当該原料が化粧品中に使用される際に、経口摂取の可能性が高い時は、亜慢性経口毒性試験を提供しなければならない。
- ①の状況に適合し、且つ国外(地域)の権威ある機構の化粧品関連原料リストに四年以上収載されているもので、人体の健康に危害を及ぼす可能性について言及する文献が無いものについては、以下の資料を提出しなければならない:
- 急性経口毒性試験及び急性経皮毒性試験;
- 皮膚刺激性/腐蝕性試験及び急性眼刺激性/腐蝕性試験;
- 皮膚感作性試験;
- 皮膚光毒性試験及び皮膚光線過敏試験(原料が紫外線吸収特性を有する際に当該二項目の試験を実施する必要がある);
- 突然変異試験(少なくとも遺伝子突然変異試験及び染色体異常試験を一項目ずつ含むこと);
- 安全に食用した歴史のあるもの、例えば国内外の政府公式機構或いは権威ある機構の発布した、或いは安全性評価を経て安全であると認められた食品原料及びその抽出物・国務院の関連行政部門の公布した食品であり且つ薬品であるとされる物品等は、以下の資料を提出しなければならない:
- 皮膚刺激性/腐蝕性試験及び急性眼刺激性/腐蝕性試験;
- 皮膚感作性試験;
- 皮膚光毒性試験及び皮膚光線過敏試験(原料が紫外線吸収特性を有する際に当該試験を実施する必要がある)
- 一種或いは一種以上の構造ユニットからない、共有結合を介して結合し、相対平均分子質量が1000ダルトンより大きい重合体を化粧品新原料とする場合は、以下の資料を提出しなければならない:
- 皮膚刺激性/腐蝕性試験及び急性眼刺激性/腐蝕性試験;
- 皮膚光毒性試験(原料が紫外線吸収特性を有する際に当該試験を実施する必要がある)。
- 国外(地域)の権威ある機構によって化粧品中に使用することが安全であると既に評価が出ている新原料については、申請時に毒性学的試験の資料を提供する必要はないが、国外(地域)評価の結論・評価報告及び関連資料を提出しなければならない。国外(地域)で承認された化粧品新原料については、さらに承認証明を提出しなければならない。
- 防腐剤・紫外線保護剤・着色剤・染髪剤の機能のいずれも有さない原料及び安全性の面から《化粧品衛生規範》の使用制限物質のリストに含む必要がないと考えられる化粧品新原料に関しては、以下の資料を提出しなければならない:
- 輸入化粧品新原料の申請者は、既に備案した行政許可在中申請責任組織の授権書の写し及び行政許可在中申請責任組織の営業許可証の写しに公印を捺印したものを提出しなければならない。
- 行政許可の補助となり得るその他の資料。
申請者は、新原料の特性に基づき、上述の要件に照らして資料を提出しなければならないが、関連要件にて適用しないとされるものについては除外する。
その他にサンプル品を一点添付して送付する。
四、化粧品新原料の審査に関する原則
- 申請者の提出する化粧品新原料の安全性評価資料の完全性・合理性・科学性について審査をおこなう:
- 安全性評価資料の内容が完全で且つ関連資料の要件に適合しているか否か;
- 根拠が科学的で、重要データが合理的で、分析が論理的で、結論が正確であるか否か;
- 化粧品新原料の由来・物理/化学的性質・使用目的・範囲・使用限度量及び根拠・生産工程・品質安全管理要件・必要な毒性学的評価資料等を重点的に審査確認する。
- 審査を経て化粧品新原料の安全性評価資料に問題が有ると考えられた場合は、審査をした専門家は化粧品監督管理関連規定及び科学的根拠に基づき、具体的意見を提示しなければならない。申請者は、規定された期限内に相応の安全性評価資料を提供しなければならない。
- 科学研究の発展に伴い、国家食品薬品監督管理局は既に承認した化粧品新原料に対しても再評価をおこなうことができる。
五、特殊な化粧品新原料の申請及び審査の要件については別途制定する。
六、略語
- IUPAC,国際純正・応用化学連合(International Union of Pure and Applied Chemistry) の略記。
- CAS,アメリカ科学情報データベースサービス(Chemical Abstracts Service)の略記。
- INCI,化粧品原料国際命名法(International Nomenclature Cosmetic Ingredient)の略記。
本指南は国家食品薬品監督管理局の責任により解釈される。
本指南は 2011 年 7 月 1 日より施行される。それ以前に発布された化粧品新原料申請及び審査に関連する規定において本指南と一致しない内容は、本指南を正とする。













