【中国国家薬品監督管理局(NMPA)による発表】1/18に「一般化粧品の登記検査管理措置の適正化に関する事項の公告」が発表されました
株式会社ワールドワイド·アイピー·コンサルティングジャパン(以下「WWIP」東京都港区)は当該公告を日本語翻訳し、弊社見解を纏めました。(一部、読みやすくするため意訳しております)
公告の日本語翻訳
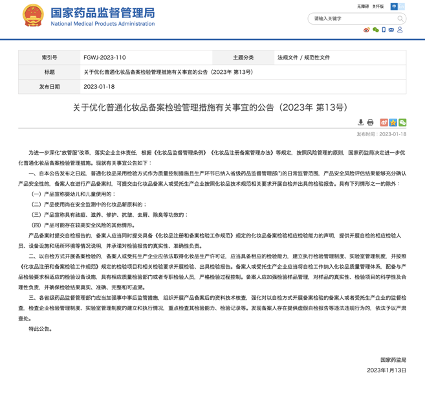
一般化粧品の登記検査管理措置の適正化に関する事項の公告(2023年 第13号) 国家薬品監督管理局は、「放管服(行政の簡素化、地方分権、サービスの最適化の意)」改革を進め、企業主体責任を果たすため、「化粧品監督管理条例」「化粧品登録登記管理弁法」およびその他規定のリスク管理の原則に従って、一般化粧品の登記検査管理措置をさらに最適化することを決定した。 関連事項について、以下の通り公告する。 一、本発表日以降、一般化粧品は品質管理措置として検査方法(訳者注:自社で検査ができることを意味する)を採用し、且つその生産工程は、省レベルの薬品監督管理当局の日常的な監督の対象になる。その製品の安全性リスク評価の結果、製品の安全性が十分に確認できる場合、化粧品技術規範の関連要件に従って化粧品登記者または受託製造者が実施して発行した検査報告書(セルフテスト)を、登記手続きのために提出することができる。 ただし、次のいずれかに該当する場合は除く。 ① 乳幼児・子供用と謳っている製品 ② 安全性監視中の化粧品新原料を使用した製品 ③ ニキビ除去、滋養、修復、抗シワ、フケ防止、消臭などの効果を謳っている製品 ④ その他、安全上のリスクが比較的高いと思われる製品 製品を登記する際にセルフテストの検査報告書が提出された場合は、「化粧品登録・登記検査作業規範」の規定に基づき、化粧品登記検査の対応する検査能力についての宣言書も提出し、対応する検査要員、機器、設備、現場環境などのセルフテストの状況説明、テスト報告書の信憑性、責任の正確さへのコミットメントを明記しなければならない。 二、登記の検査として、セルフテストの方法を採用した場合、登記者または受託生産企業は、法律に従って化粧品生産許可証を取得しなければならず、適切な試験能力、試験管理制度、実験室管理制度を確立し、且つ「化粧品登録・登記検査作業規範 」の試験項目と試験要件に従って、試験を実施し試験報告書を発行する。登記者または受託製造業者は、化粧品の品質管理制度にセルフテスト作業を導入し、製品の検査要件に適応する検査機器や設備を設置し、適切な品質検査部門または専任の検査担当者を配置し、検査プロセスを厳格に制御する。登記者は、試験サンプルの管理を強化し、サンプルの真正性、試験項目の科学性及びその合理性に責任を持ち、試験結果が真実、正確、完全かつ追跡可能であることを保証するものとする。 三、各省レベルの薬品監督管理部門は、申請中及び申請後の規制措置を強化し、登記した製品の資料について、技術的検証を実施し、セルフテストによる登記検査を実施する登記者または受託製造者の監督・検査を強化し、企業の検査管理制度、実験室の管理制度とその検査能力、検査記録などを中心に、状況の確立と実行状況を確認すべきである。登記者が虚偽のセルフテスト報告書を提出するなどの違法行為が判明した場合、法律に基づき厳重に調査し処罰される。
- 弊社見解
NMPA申請前には、CMA認定を受けた中国の検査機関で検査を実施する必要があります。
当該通知の内容は、「普通化粧品を申請するにあたり、条件を満たせば登記者もしくは受託製造者が実施した検査報告書をNMPA申請に使える」というものですが、その条件について、弊社では以下のように考えます。
1. 生産工程が監督対象となる
登記者もしくは受託製造者が実施した検査報告書を提出する場合の条件の1つとして、「その生産工程は、省レベルの薬品監督管理当局の日常的な監督の対象になる」とありますが、中国当局が海外企業の生産工程を監視するのは容易ではないので、海外企業は当該通知の対象外ではないかと考えられます。
尚且つ、自社での検査結果が必要なので、中国企業であっても、検査能力を保有しない企業は対象外となると考えれます。
2.製品の安全性が十分確認できる場合
“製品の安全性が十分確認できる場合”の具体的な基準は示されていませんが、恐らく“配合成分が、NMPAが設定している最高歴史使用量(その成分が中国でこれまで使用されたことのある最高配合量)を超えていない”“安全評価報告書(NMPA申請書類の1つ)の内容が十分製品の安全性を示しうる内容のもの“原産国で長い販売実績がある”等の状況を指すと考えられます。
3.検査能力に関する宣言書
“化粧品登録・登記検査作業規範の規定に基づき”とありますが、当該規範は2019年に発表された検査規定であり、中国における検査機関の条件や責務等が規定されています。
検査能力の宣言書を出す場合、この規範に記された製造環境の条件を満たしていることを説明する必要があります。
4.化粧品生産許可証
「検査実施する登記者もしくは受託製造者が中国法規に従い”化粧品生産許可証”を取得しなければならない」とありますが、化粧品生産許可証とは日本における化粧品製造業許可証にあたるものです。この点から見ても、海外企業は当該通知の対象外ではないかと考えられます。
5.NMPAによる管理監督
登記者もしくは受託製造者が実施した検査報告書を提出した場合、NMPAはより厳しくチェックを行う旨があり、万一不正が発覚した場合は罰則が科されます。
現時点では海外企業が検査実施することが可能かどうか明確になっていませんが、恐らく対象外であると予想されます。
今後発表される通知で“海外企業も対象とする”とされたとしても、主なメリットは「既存の試験データを使用できる可能性があること」「サンプルを中国の検査機関へ発送する時間と費用の節約になること」、デメリットは「NMPAから厳しいチェックを受けること」「問題が生じた場合、罰則を受けるリスク」であり、総合的に見てデメリットの方が大きいのではないかと考えられます。
本件に関して今後発表される関連通知にも注視し、随時皆様へお知らせして参ります。
WWIPでは、NMPA法規制全般のコンサルティングサービスを提供しております。中国に於ける化粧品申請など詳細については、不明点があればお気軽にお問い合わせ下さい。
<本件に関するお問い合わせ>
株式会社WWIPコンサルティングジャパン
TEL : 03-6206-1723
Email: official@wwip.co.jp