中国化粧品安全評価資料提出ガイドライン(意見募集稿)、中国食品薬品検定研究院が3月29日公表。化粧品を3つに分類し、自己審査を導入。
2024年3月29日、中国食品薬品検定研究院は、「化粧品安全性評価資料提出ガイドライン(意見募集稿)等、2つの技術文書に関する意見公募の通知」と題する通知を公表しました。
通知に添付された文書は以下の4件、意見募集の期間は4月8日までとされています。
- 化粧品安全評価資料提出ガイドライン(意見募集稿)
- 添付1:化粧品安全性評価報告書自己審査要点
- 添付2:化粧品安全性評価結論(雛形/ 記載例)
- 添付3:化粧品安全性評価報告書の概要(自己チェックリスト)
- 化粧品安全評価資料提出ガイドライン(意見募集稿)起草説明
- 化粧品リスク物質の特定と評価技術ガイドライン(意見募集稿)
- 化粧品リスク物質の特定と評価技術ガイドライン(意見募集稿)起草説明
化粧品安全評価報告書(完全版)移行が2024年5月1日に迫る中、当局の何らかの緩和措置が期待されていますが、今回の意見募集稿は、その期待に応えられるものではありません。
当ニュースリリースでは、
上記1,2「化粧品安全評価資料提出ガイドライン(意見募集稿)」について取り上げています。
上記3,4「化粧品リスク物質の特定と評価技術ガイドライン」については、こちらをご参照ください。
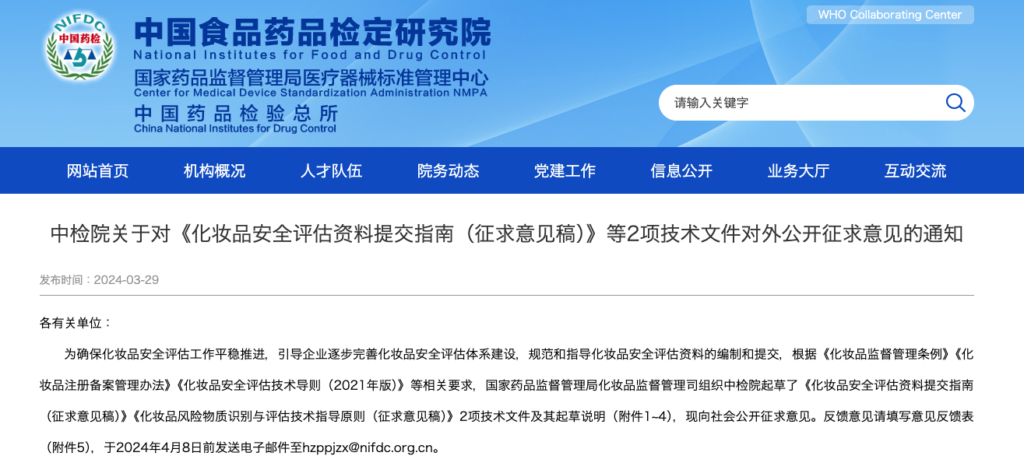
化粧品安全評価報告提出ガイドライン
今回の意見募集稿のポイントは以下の通りです。
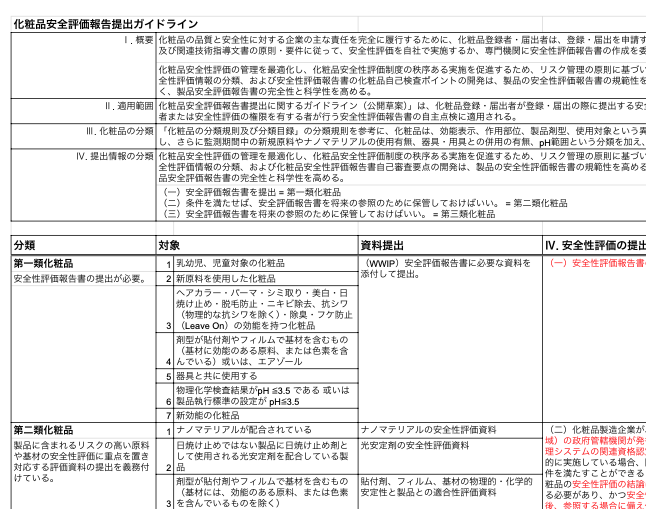
| Ⅰ. 概要 | 化粧品の品質と安全性に対する企業の主な責任を完全に履行するために、化粧品登録者・登記者は、登録・登記する前に、「化粧品安全性評価技術ガイドライン(2021年版)」及び関連技術指導文書の原則・要件に従って、安全性評価を自社で実施するか、専門機関に安全性評価報告書の作成を委託する必要がある。 | ||||
| 化粧品安全性評価の管理を最適化し、化粧品安全性評価制度の秩序ある実施を促進し、リスク管理の原則に基づいて、企業の主な責任を完全に履行する。「化粧品安全性評価報告書の自己審査要点」は企業が製品安全性評価を行い、製品安全性評価報告の規範性、完全性、科学性を向上させるための指針となる。 | |||||
| Ⅱ. 適用範囲 | 「化粧品安全評価資料提出ガイドライン(意見募集稿)」は、化粧品登録・登記者が登録・登記の際に提出する安全性評価情報の内容の決定や、化粧品企業の品質安全責任者または安全性評価の権限を有する者が行う安全性評価報告書の自主審査に適用される。 | ||||
| Ⅲ. 化粧品の分類 | 「化粧品分類規則及び分類目録」の分類規則を参考に、化粧品の効能表示、作用部位、製品剤型、使用対象群の異なる分類に基づき、製品の種類ごとのリスクを総合的に考慮する。さらに安全測定期間中の新原料やナノマテリアルの使用有無、器具・用具との併用の有無、pH範囲という分類を加え、化粧品のリスクの程度に応じて3つのカテゴリに分類する。 | ||||
| Ⅳ. 提出情報の分類 | 化粧品安全性評価の管理を最適化し、化粧品安全性評価制度の秩序ある実施を促進するため、リスク管理の原則に基づいて、企業の主な責任を完全に実装し、状況に提出された化粧品安全性評価情報の分類、および化粧品安全性評価報告書自己審査要点の開発は、製品の安全性評価報告書の規範性を高めるために、製品の安全性評価作業を実施するために企業を導く、製品安全評価報告書の完全性と科学性を高める。 | ||||
| (一)第一類化粧品:安全評価報告書を提出 。 (二)第二類化粧品:条件を満たせば、申請時には安全評価報告結論のみ提出し、安全評価報告書は将来のチェックのために保管しておけば良い 。 (三)第三類化粧品:申請時には安全評価報告結論のみ提出し、安全評価報告書は将来のチェックのために保管しておけば良い。 | |||||
第一類化粧品
| 1 | 乳幼児、児童対象の化粧品 |
| 2 | 新原料を使用した化粧品 |
| 3 | ヘアカラー・パーマ・シミ取り美白・日焼け止め・抜け毛予防・ニキビ、抗シワ(物理的な抗シワを除く)・消臭・フケ防止(Leave On製品)の効能を持つ化粧品 |
| 4 | 剤型が貼付型、フィルム型、基材型(基材に効能のある原料、または色素を含んでいる)或いは、エアゾール |
| 5 | 器具や道具と共に使用する(ブラシ、エアクッション、パーマ道具など、塗布を補助するだけのものを除く) |
| 6 | 物理化学的試験結果がpH ≦3.5 或いは製品執行標準の設定が pH≦3.5以下のLeave On製品 |
| 7 | 新効能を持つ化粧品 |
第二類化粧品
| 1 | ナノマテリアルを配合している化粧品 |
| 2 | 日焼け止め化粧品以外で光安定化剤として日焼け止め剤(成分)を配合している化粧品 |
| 3 | 剤型が貼付型、フィルム型、基材型(基材に効能のある原料、または色素を含んでいるものを除く) |
| 4 | 口唇、目の周りに使用する化粧品 |
| 5 | フケ防止(Rinse Off)、脱毛、角質除去の効能を謳う化粧品 |
第三類化粧品
第一類、二類以外の化粧品
WWIPコメント
「化粧品安全評価報告提出ガイドライン」により化粧品安全評価に、自己審査と備え置き(当局には安全評価報告書を提出する必要がなく、自社で保管しておく)が導入されたことは大きな変化です。
しかし、当局に提出する必要がなく、自社で保管するといっても、安全評価報告書の内容の要求は変わりません。
結果、第二類、三類に分類された化粧品であったとしても原料の安全性評価、そのエビデンスの収集などは、第一類化粧品と変わらず、依然として高いハードルにあります。
(添付1)化粧品安全性評価報告書自己審査要点
自己審査要点には、原料の安全性評価エビデンスの提出方法について、具体的に述べられています。
| 1 | 化粧品安全技術規範 | 中国化粧品安全技術規範を参照する。 | ||
| 2 | 国内外の権威ある機関の評価結論 | 米国の化粧品成分評価委員会(CIR)や欧州連合の消費者安全科学委員会(SCCS)などの国内外の権威ある機関は、化粧品の使用に関する評価結論を持っており、その評価結論は、中国の関連法規およびその使用条件に準拠している限り、原料として使用することができるため、各毒性エンドポイントを評価する必要はない。 | ||
| 原料の使用条件または実際の暴露が SCCS や CIR 評価レポートの適用範囲内にない場合、SCCS や CIR レポートにある原料の毒性エンドポイントデータを使用して、実際の暴露下での原材料を評価することができる。 | ||||
| 世界保健機関 (WHO)、国連食糧農業機関 (FAO)、欧州食品安全機関 (EFSA)、欧州医薬品庁 (EMA)、米国食品医薬品局 (FDA) 、中国食薬局等の化粧品の安全な使用に関する結論、国際香粧品香料協会 (IFRA) が発行する規格等は、中国の化粧品に関する関連規制に準拠していれば採用できる。 | ||||
| 3 | その他のエビデンス | 安全な食用履歴および 3 年間の安全な使用履歴のある原料の評価については、「化粧品安全評価語術ガイドライン」の要求を参照して評価を行うことができる。 「化粧品安全評価技術ガイドライン」および関連ガイダンスを参照し、エビデンスを適用するための前提条件が満たされているかどうかを詳細に分析する必要がある。 | ||
| 4 | 上記1-3がいづれも参照できない場合 | 上記のエビデンスのいずれも使用できない原料については、「化粧品安全技術ガイドライン」のリスク評価手順に従って評価を実施する必要がある。(評価方法に関する記載あり) | ||
| 5 | 特定の化粧品成分の安全性評価 | (1)香料, (2)ナノマテリアル, (3)ヘアカラー製品に含まれる着色料 | ||
| (4)原料を評価する際には、配合成分として使用されていない極微量成分(化粧品原料の品質を確保するために原料に添加される微量成分、化粧品原料に添加される加工助剤など)についても対応する必要がある。原料の品質や安全性に影響を与えないよう、製品の生産工程で使用される成分(製品の生産工程で使用され、その後の生産工程で除去される薬剤等)を一つ一つ説明し、十分な安全性評価を行うこと。 | ||||
| (5)監測期間中の新原料:製品に使用される新原料を安全監視期間中に評価する場合、原料の使用目的、使用・適用範囲、使用濃度、使用上の制限・要求事項が、新原料の技術的要求事項に適合しているかを評価する必要がある。 | ||||
WWIPコメント
自己審査要点で述べられている原料の安全性エビデンスの提出方法(エビデンスとして認められる内容)は、2024年5月1日に予定されている安全評価報告書(完全版)の域を越えるものではありません。期待されていた、「既使用化粧品原料目録の過去最高実績使用量をあらためて安全性エビデンスの根拠として認める」ことには触れられておらず原料の安全性の示し方は依然として高いハードルにあります。
* 自己審査要点中、3の「その他エビデンス」にある「3 年間の使用履歴のある原料の評価」とは、現在の化粧品安全性評価技術ガイドラインでは、「簡易版」で採用可能とされていたもの(化粧品安全性評価技術ガイドライン 9.1簡易版で採用可能な根拠資料 / 9.1.3)であり、「完全版」で認められたことは前進といえるが、そもそも条件が厳しく、これをもって多くの原料の安全性が示せることにはなりません。
化粧品安全性評価技術ガイドライン 9.1.3
登録者・登記者が既に少なくとも3年販売している同一の使用方法の製品中の原料濃度(即ち、登録者・登記者のこれまでの使用濃度)は評価の根拠資料となる。使用部位及び使用方法が同一の製品配合中の原料の使用濃度は原則、登録者・登記者の今までの使用濃度より高くなってはならないが、もし今までの使用濃度より高くなる場合は、本ガイドラインに照らして安全性評価をおこないその安全性を証明しなければならない。原料の過去の使用濃度を参考にすることができ、暴露量が高く接触時間が長い製品のものは、暴露量が低く接触時間が短い製品の評価に用いることができるが、対象のコホート・使用部位・使用 方法等の面からその合理性について充分な分析・説明をする必要がある。
登録者・登記者の今までの使用濃度を使用する際に提供しなければならない証明書類には以下の内容を含む:(1)国産特殊化粧品及び輸入化粧品:登録或いは登記する配合(申請時に提出する配合と一致させる必要がある)・製品登録証書或いは登記証明書・製品販売開始証明書類。(2)国産普通製品:原料含量が記載された或いは原料含量を計算できる生産記録・工程表・配合表・登記証明書・製品販売開始証明書類。(3)副作用監視測定状況の説明。(4)その他の証明書類。
WWIP既報「中国医薬報」で報道された当局担当者のコメントでは「国家薬品監督管理局が改革を推進し、ビジネス環境を最適化し続けるための重要な措置として、業界が直面している課題を効果的に解決支援するため、技術指導文書、技術指導原則、原料安全性データを提供します」とあり、このコメントを踏まえ、目前に迫った5月1日化粧品安全評価報告書の完全版移行前に、現在最も難航している原料の安全性の示し方について、追加措置があるものと期待します。
↓ WWIPで「化粧品安全評価報告提出ガイドライン」の内容を整理、まとめた資料です。
データをダウンロードし確認するためにはパスワードが必要です。
パスワードはWWIPとコンサルティング契約を締結済みの企業様には別途メールにてお送りしています。パスワードが届いていない方、貴社のセキュリティでダウンロードができない方は貴社名を明記の上、official@wwip.co.jp までご連絡ください。
中国語原文のダウンロードはこちら
WWIPでは、ニュースリリースに関する皆さまのご意見・ご感想を募集しております。(匿名投稿)
いただいたご意見を踏まえ、より皆さまのニーズに合う情報をお届けできるよう努めて参りますので、以下ボタンよりお気軽に投稿ください。
<本件に関するお問い合わせ>
株式会社WWIPコンサルティングジャパン
TEL : 03-6206-1723
Email: official@wwip.co.jp