【中国化粧品新原料】国家薬監局(NMPA)公布:「化粧品原料の革新を支援するための若干の規定(2025年第12号)」に関する公告
2025年2月6日、中国国家薬品監督管理局(以下、NMPAとする)は「化粧品原料の革新を支援するための若干の規定に関する公告(2025年第12号)」を発表しました。
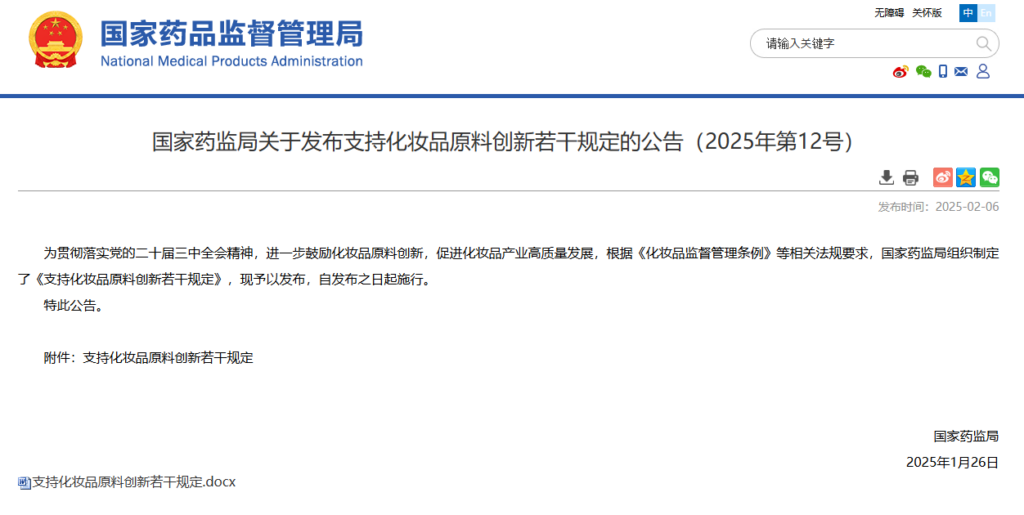
この公告は、化粧品原料の革新をさらに奨励し、化粧品産業の高品質な発展を促進することを目的としています。また、中国共産党第二十回中央委員会第三回全体会議の精神を貫徹し、「化粧品監督管理条例」などの関連法規に基づき、NMPAは「化粧品原料の革新を支援するための若干の規定」を策定しました。
なお、本規定は公布日(2025年2月6日)より施行されます。
今回挙げられた9つの規定を以下の通りご紹介します。
※下記の内容には、皆さんが少しでもお読みになりやすいように、一部、言葉を補った意訳も含んでおります。ご了承ください。
※特に注目すべき箇所にはハイライトを入れております。
1) 新原料の登録・登記分類技術要求の最適化
化粧品新原料の登録・登記分類管理および技術評価システムを改善します。原料の特性、効能(機能)、予想される用途、革新の特徴(新規性や独自性等)に応じて、技術的な要求を最適化し、企業が新原料の判定と分類を行うための技術的な指導を強化します。国内外で初めて使用される新原料については、実際のリスクの程度を考慮して、新原料の安全評価に関する関連要件を最適化します。企業が科学的な方法で安全評価を実施することを前提に、毒性学試験および長期間のヒト試験に関する一部の安全性試験要件を軽減または免除する措置を講じます。すでに十分な安全使用歴のある新原料に対しては、安全使用歴と安全食用歴に関する歴史的な研究・判定基準を明確にし、既存データの活用を強化すると共に、安全性評価に関する関連要件を簡素化します。既存原料を改良した新原料については、安全使用歴を十分に考慮した上で、相応の技術的要求を策定します。また、すでに市場に出ている新原料の変更方法を明確にし、その変更に関する研究の技術指針を策定します。
2)新原料と関連製品の同時申請の推進
新原料と化粧品の関連する研究の連携を強化し、新原料および化粧品の審査・承認の効率を向上させ、新原料を用いた(配合した)製品の市場投入を加速させます。新たに登録・登記を行う新原料については、その新原料を使用する特殊化粧品の登録申請も同時に行うことを奨励します。化粧品のスマートな審査システムを最適化し、新原料の登録・登記や、新原料を使用する(配合する)特殊化粧品の登録申請に対して、より一層便利で充実したサービスを提供いたします。
3)新原料の革新サービスと応用転化の強化
新原料の革新と応用を支持し、一定の条件に適合する、我が国(中国)で初めて市場に投入される予定の新原料については、現代の科学技術を駆使し、我が国(中国)の伝統的な強みや特色ある植物資源を組み合わせた研究開発を行います。このような新原料に対しては、早期の段階で介入し、開発の全過程を通じて指導を行うことにより、新原料の研究開発の質を向上させ、その応用の進展を加速させます。上述の条件を満たす新原料の登録申請およびその新原料を使用する(配合する)特殊化粧品に対しては、専用の審査ルートを設け、優先的に審査を行うことで、新原料および製品の市場投入を加速いたします。
4)新原料の技術指導とコミュニケーションの強化
新原料の命名に関する技術指針をはじめとする一連の研究に関連する技術的指導原則を迅速に策定し、共通の問題に対する技術的なQ&Aをタイムリーに公開することで、新技術や新しい方法の応用研究および技術的な指導を一層強化いたします。また、化粧品新原料に関するコミュニケーションと交流の仕組みをさらに最適化し、登録・登記前や審査・確認の過程でのコミュニケーションを強化することで、企業が登録・登記業務を規範的に実施できるように指導いたします。国家の化粧品審査部門と省級の薬品監督部門との技術的な交流と連携を強化し、一定の条件と能力を備えた省級薬品監督部門を選定して、事前相談、コミュニケーション、追跡指導などの分野でその積極的な役割を十分に発揮できるようにします。
5)新原料の安全監視期間管理の改善
新原料の安全監視期間に関する管理体制を整備し、登録、審査、標準(基準)、副作用の監視、情報化などの業務において、各部門の協力と地域間の連携を強化します。新原料を使用した化粧品の副作用監視を強化し、化粧品の副作用監視ネットワークを拡充・改善することで、副作用の分析と評価を強化し、関連するリスク信号を迅速に発見します。人体への傷害を引き起こす、または人体の健康に危害を及ぼす可能性があることを証明する証拠がある化粧品に対しては、迅速にリスク管理措置を講じます。さらに、既に使用されている原料のリスト(已使用原料目录)に関しては、動的に調整する(適時に調整する)ための仕組みを構築することを研究します。
6) 化粧品原料標準(基準)研究に関する技術指導の強化
我が国(中国)の化粧品の定義や分類に関する技術的要件、また化粧品の処方や生産に必要な要件を基に、化粧品原料の使用目的に関する技術的ガイドラインを策定します。さらに、生物技術や植物資源など、異なる種類の化粧品原料に関する技術要件を段階的に確立し、その上で化粧品原料に関する共通の技術要件を研究し、化粧品原料の標準(基準)の向上を促進します。
7)化粧品原料の標準(基準)の策定・改訂作業の推進
NMPAの化粧品標準化技術委員会の役割を十分に発揮させ、業界で使用量が多く、安全リスクが高い、または我が国(中国)の伝統的かつ優位な特色のある原料の標準(基準)策定を優先的に行います。国内外の化粧品原料標準(基準)管理の動向を追跡し、化粧品の安全リスク監視および評価の状況を参考にし、国際的な権威ある機関の最新の安全評価結果などを活用して、標準(基準)の転化を進めます。引き続き、化粧品原料の標準(基準)の策定・改訂作業を推進します。
8)原料に関する基礎研究の強化
化粧品原料の生産技術、品質標準(基準)、安全評価、効果評価などの研究を強化し、化粧品原料の品質向上を図ることを奨励します。動物実験代替法の技術研究を深化させ、新原料の安全評価における応用を加速させます。NMPAの化粧品監督管理科学基盤プラットフォームおよび重点プロジェクトをベースに、新技術、新方法、そして新標準(基準)が化粧品原料の革新的な研究開発および監督管理において応用されるよう推進します。
9)化粧品原料の情報化建設の強化
化粧品新原料およびその登録者・登記者に関する情報ファイルを構築し、新原料と化粧品に関するデータの相互連携と情報共有を強化することで、新原料および新原料を使用した(配合した)化粧品の監督管理に対するデータ支援を提供します。さらに、原料管理プロセスにおけるデータ活用の場面についての研究と分析を強化し、業界に対して情報提供とサービスを行います。
WWIPでは中国化粧品新原料申請の申請コンサルティングと申請代行業務をサービスとして提供しておりますので、今後も化粧品新原料に関する動向について引き続きウォッチングを進めてまいります。
また、今年の1月にWWIPが新原料申請の申請コンサルティングと申請代行業務を実施し、動物実験代替法により新原料申請の承認を得た内容、そして同じく1月に実施しましたWWIP主催の化粧品新原料セミナーに関する内容を以下に掲載いたしますので、ご参考になれば幸いです。
<本件に関するお問い合わせ>
株式会社WWIPコンサルティングジャパン
TEL :03-6206-1723
Email:official@wwip.co.jp