【中国】中検院が「化粧品新原料に関する技術FAQ」を発表
2025年3月17日、中国食品薬品検定研究院(中検院)が「化粧品新原料に関する技術FAQ」を発表しました。WWIPが日本語に翻訳したものを用いて、当該FAQの内容をお知らせいたします。なお、翻訳の中には一部意訳も含まれています。翻訳の内容を保証するものではありません。必ず原文をご確認いただけますようお願いいたします。
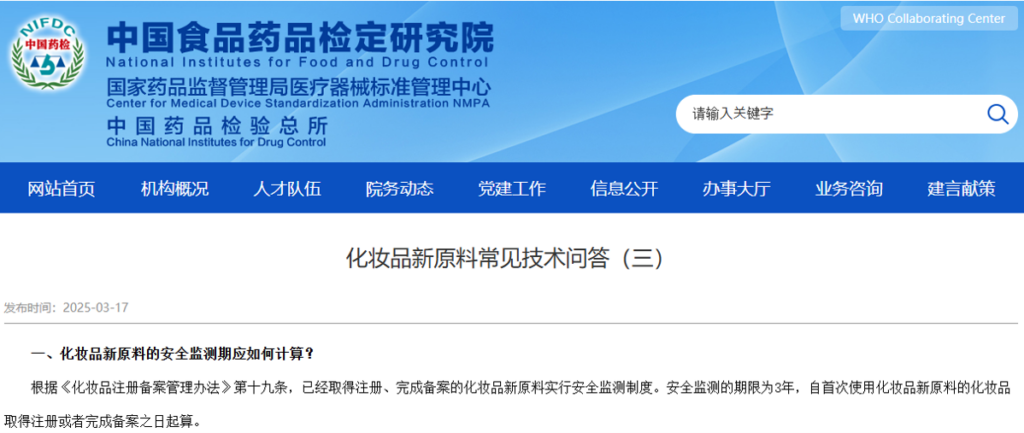
1. 化粧品新原料の安全性モニタリング期間はどのように計算されるべきでしょうか?
《化粧品登録登記管理弁法》第19条に基づき、登録を取得し登記を完了した化粧品新原料は、安全性モニタリング制度を実施しなければならない。安全性モニタリング期間は、化粧品新原料を初めて使用した化粧品が登録または登記された日から3年間です。
2. 安全性モニタリング期間中、新原料の登録者/登記者、及び新原料を使用した化粧品の登録者/登記者はどのような義務がありますか?
新原料の登録者/登記者は、新原料が市場に投入された後、安全リスクモニタリングと評価システムを確立し、新原料の安全性に関する追跡研究を実施し、その使用及び安全性を継続的にモニタリング及び評価しなければならない。新原料の使用と安全状況について総括・分析し、要求に応じて指定期限内に「年度報告書」を提出しなければならない。新原料が《化粧品登録登記管理弁法》第22条に規定された状況にある場合は、直ちに調査を実施し、必要なリスク管理措置を講じ、直ちに「リスク管理報告書」を提出しなければならない。
新原料を使用して化粧品を製造する化粧品登録者/登記者は、新原料の使用及び安全状況について、新原料の登録者/登記者に対して速やかにフィードバックしなければならない。新原料に関連する可能性のある化粧品の不良反応や安全性の問題が発生した場合は、直ちにリスクを抑制する措置を講じて、新原料登録者/登記者に通知し、尚且つ規定に従い所在地の省、自治区、直轄市の薬品監督管理部門に報告しなければなりません。
3. 新原料の登録者/登記者は、いつ年度報告書を提出する必要がありますか。また、年度報告書にはどのような内容を含める必要がありますか?
《化粧品登録登記管理弁法》第21条に基づき、新原料の登録者/登記者は、新原料安全モニタリング期間が1年となるその30営業日前から満1年までの間に、化粧品新原料の使用および安全性の状況について総括分析してまとめ、報告書はNMPAに提出しなければならない。
《化粧品新原料登録登記資料管理規定》によれば、年度報告書は、通常以下が含まれなければならない;新原料を使用して生産された化粧品に関わる化粧品登録者/登記者或いは化粧品生産企業の情報;新原料を使用して生産された化粧品の情報;新原料を使用して生産された化粧品の監督抜き取り検査、処罰、リコール状況;副作用モニタリングに関する状況;リスクモニタリングと評価に関する状況等。 具体的な作成要件は、《化粧品新原料登録登記資料管理規定》添付7を参照のこと。年度報告書は「化粧品登録・登記申請審査システム」を通じて提出されます。
4. 新原料の登録者/登記者は、どのような状況ではリスク管理報告書を提出する必要があり、またリスク管理報告書にはどのような内容を含める必要がありますか?
《化粧品登録登記管理弁法》第22条によると、新原料の登録者/登記者は、以下の状況のいずれかを発見した場合、直ちに調査を行い、技術審査機関に対して報告しなければならない。(1) その他の国(地域)で、類似の原料の使用が原因と疑われる重大な化粧品副作用または集団副作用が発見された場合。(2) その他の国(地域)の化粧品法規、標準が類似の原料に対して使用基準を引き上げたり、使用制限を増したりまたは使用を禁止したりする場合。(3) その他化粧品新原料の安全性と関連する状況。また、化粧品新原料に安全性上の問題があるという証拠がある場合は、新原料の登録者/登記者は、直ちにリスク管理措置を講じ、技術審査機関に報告しなければならない。
《化粧品新原料登録登記資料管理規定》によれば、リスク管理報告書には通常以下が含まれなければならない;新原料に関する基本情報、生産および使用状況、安全上の問題または緊急事態の原因分析、講じられた措置および処理結果等。具体的な作成要件については、《化粧品新原料登録登記資料管理規定》の添付8を参照のこと。リスク管理報告書は「登録・登記申請審査システム」を通じて提出されます。
5. 年度報告書やリスク管理報告書を提出する際、同時にその他の資料情報も一緒に提出しても良いですか?
《化粧品新原料登録登記資料管理規定》に基づき、一部の技術資料は年度報告書と一緒に提出しても構いません。例えば、国内外で初めて使用される新原料については、登録/登記時に少なくとも3ロットの原料の加速試験データまたは1年以上の長期保存試験データを提出しなければなりませんが、残りの使用期間の長期保存試験データは、年度報告書で1回または毎年補足することができます。
《化粧品新原料登録登記資料管理規定》で認める状況を除き、年度報告書やリスク管理報告書に関係のないその他の資料の提出は無効とみなされます。
今回のFAQは既にNMPAが発表しているルールを説明したもので、新しい内容は含まれていません。しかし、ややわかりづらいルールであるため、弊社もよくお客さまから同様のご質問をいただいております。
原料会社様にとっては“新原料登録・登記の承認を得た後の対応義務”として、化粧品会社様にとっては“安全監視測定期間中の新原料を化粧品に使用した場合の原料会社様への協力事項”として、当該FAQ翻訳をお役立ていただければと思います。
なお、新原料申請をご検討中のお客さまは、お気軽に以下へお問合せください。