中国国家薬品管理監督局が11月10日から施行される新しい化粧品申請制度を発表
中国国家薬品管理監督局が11月10日から施行される新しい化粧品申請制度(旧CFDA, 現在はNMPAと呼称変更)を発表。 大幅な制度変更により参入障壁となっていた化粧品申請に朗報。
中国中央政府国務院は、10月10日に、現在政府が実施している全国106の申請承認手続きについて、ビジネスの活性化とビジネス環境の国際的な促進を図ることを目的に改革を行うと発表しました。(国務院:国発[2018] 35号)
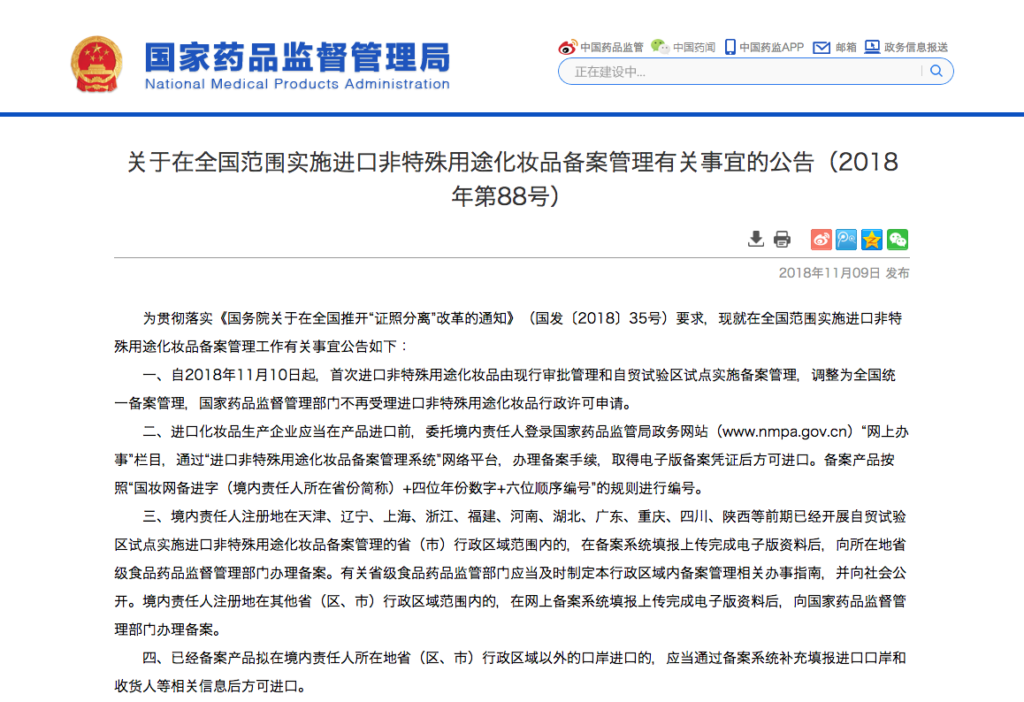
この発表を受けて、11月9日に国家薬品管理監督局から制度変更に関する文書が発表されました。
株式会社WWIPコンサルティングジャパン(東京都港区西新橋1-17-11 代表取締役 神代雅喜)は、当発表を翻訳、意味を補完するための追記を挿入した文書をリリースします。
※ 当文書はWWIPコンサルティングジャパンが中国国家薬品管理監督局の11月9日の発表を翻訳したものです。文章中の( )部分は弊社が意味を補完するために追記した箇所です。
※ 弊社は当翻訳並びに意訳追記した文書の誤訳等につき一切の責任を負いません。
株式会社WWIPコンサルティングジャパン(東京都港区西新橋1-17-11 / 03-6206-1723)
以下、発表本文
https://www.nmpa.gov.cn/WS04/CL2138/331915.html
中国全土を対象とした輸入非特殊目的化粧品に関する備案管理の実施に関する発表
<2018年第88号>
「国務院が発表した“証照分離”改革の通知」(国発<2018>35号)の要求を実現するため、輸入非特殊目的化粧品に関する備案管理の実施について以下の事項を発表する
1. 現在、海外から初めて輸入される非特殊化粧品は、通常の審査承認(北京総局で行っている一般申請)と自由貿易試験区で備案管理(備案申請)されていますが、
2018年11月10日より、全国統一で備案管理(備案申請)に切り替えます。
今後、国家薬品監督管理部門(北京総局)は輸入目的の非特殊化粧品の一般申請の受付をとりやめます。
2. 輸入化粧品製造企業は、製品を輸入する前に、境内責任者(備案申請における在中責任会社)に委託し、国務執行管理のウェブサイト<www.nmpa.gov.cn>(NMPA : CFDAの現在の呼称 National Medical Products Administration) の「オンラインサービス(備案管理システム)」に登録し(申請者情報など、現在のID取得手続き)、「輸入非特殊用途化粧品の備案管理システム」を通じ、備案手続きを進める。(備案手続きが終了すると)電子版の備案証明が発行され 輸入することができる。
電子版の備案登録証明を入手した後、(輸入)登録手続のためのプラットフォームに、(当該登録番号を)インポートすることができます。
備案製品の番号は、「<境内責任者が所在する省の略称>+ 4桁の年番号+ 6桁の順序番号」の規則により発行されます。
3. 境内責任者が登録できる地域(備案申請ができる地域)は天津、遼寧、上海、浙江、福建、河南、湖北、広東、重慶、四川、陝西など、すでに前期(現在、備案申請を受付してい地域)の自由貿易試験区の試行地域で、輸入非特殊用途化粧品の備案管理を行っている省(市)の行政区域範囲内の場合は、備案管理システムにデジタル版の資料をアップロードした後、所在地の省庁食品薬品監督管理部門で備案手続きを進める。
(この場合)関係省庁の食品薬品監督部門が、行政地域内の備案管理に関する手続きを直ちに制定(整備)し、一般に公開する。
境内責任者の登録地が上記地域以外(現在、備案申請を受付けている地域以外)の場合、オンライン備案システムにデジタル版の資料をアップロードした後は、国家薬品監督部門(北京総局)にて備案手続きを行う。
4. すでに備案を取得済みの商品を在華責任会社の所在地の省(区、市)の行政地域以外の港から輸入したいと考える場合、事前に備案システムを通じて荷受人、輸入港などの情報を登録する必要がある。
5. 非特殊化粧品の備案申請を行いたいと考える輸入化粧品製造会社は「上海市浦東新区における輸入非特殊化粧品備案管理システムの公布に関するお知らせ<暫定>」<2018年 第10号>を参照し、境内責任者の授権・備案管理システムの登録・製品備案情報の登録・備案登録証明書の印刷(発行)などを進めてください。
輸入非特殊化粧品の検査報告、OEM委託製造企業は「上海市浦東新区における非特殊化粧品輸入検査報告等の実施要件のお知らせ」<食品薬品監督管理2017 72号>を参照してください。
6. 2018年11月10日前に、行政ライセンス申告が、国家薬品監督管理部門に受理されている輸入非特殊用途化粧品(即ち一般申請で進めている非特殊化粧品)について、申告者は2018年11月20日までに、国家薬品監督管理部門に申請した行政ライセンス申請を撤回することができ、その後、境内責任者を通じて本発表どおりの備案申請を行う(ことができる)。(11月20日の)期限を過ぎても撤回しない場合、国家薬品監督管理部門は当初の手順に従って技術審査を継続し、合格した製品は、(従来通りの)紙媒体の非特殊用途化粧品備案の証明書を発行する。
2018年11月10日前に(既に)輸入非特殊化粧品の行政許可の申請が完了したものの、まだ証明書が発行されていない製品に対しては、製品安全上の理由で承認されていないものを除き、本発表の関連要件に従って備案申請手続きが行われる。
7. 従前の審査承認管理の規定に基づき、輸入非特殊用途化粧品の行政ライセンス(備案登録証明書)をすでに取得している場合は、ライセンス有効期間中においては、国家薬品監督管理部門が発行した紙の証明書によって輸入を行うことができる。
その期間中に再発行または修正する必要がある場合は、従来の規則によって処理する。ライセンス有効期間の終了後、継続して輸入が必要な場合、または有効期間が終了する前に元の(基本的な)行政ライセンス事項に変更がある場合、本発表の要件に従って備案手続きを進め輸入する(必要がある)。
8. 各級(省もしくは市)の医薬品監督部門は、輸入製品の備案申請中、備案申請後(申請が終了し証明書が発行された後)の管理監督を強化すべきである。
税関などの関連部門との(連携と)調整を強化し、適時、製品品質の安全性情報を報告し、法律に従って関連部門と法令違反行為を調査し、処理を行う。
以上
WWIPコンサルティングジャパン(東京都港区西新橋1-17-11 代表取締役 神代雅喜 以下「WWIP」)は、中国国内の提携関係にある6社(北京2社、天津2社、上海、杭州)との連携を強化。
急増が予想されるNMPA(旧CFDA)登録申請に対応する体制をとっています。
無料で化粧品の成分チェック(中国での禁止成分など)を承っています。
お気軽にお問い合わせください。
WWIPのサービス
(1) 日本国内でのワンストップサービス → 打ち合わせは、中国人スタッフを含めて全て日本語で行ないます。
(2) 中国出身の専門スタッフによるCFDA申請サポート体制 →
東北大学にて薬学修士を取得し、日本国内で診断薬の研究開発、
医療ビジネスの海外マーケティングなどを経験。その後医薬品安全性情報業務(PV)に従事。
(3) 中国での境内責任会社に関してもサポート → 中国国内で申請者となる境内責任会社を無償でご紹介します。
(4) 申請前の成分チェックは無料 → 中国への輸出可能な成分かどうかなど、申請前にチェックを行います。
※ 申請可否については無料でチェック。申請できない場合は一切費用は発生しません。
(5) 明朗な料金表 → 検査機関や行政機関へ支払う費用とWWIPの申請代行手数料を明朗に分けて表記しています。
中国で化粧品を販売したい日本企業にとって高いハードルとなっているNMPA(旧CFDA)申請ですが、非特殊化粧品に限って言えば、備案申請代行サービスを利用することで、迅速に商品の販売を開始する事が出来ます。
まずは、対象化粧品の成分チェックをお申し付けください。(20成分まで無料)
《株式会社WWIPコンサルティングジャパン 概要》
商 号 : (株)ワールドワイド・アイピー・コンサルティングジャパン
代表者 : 代表取締役CEO 神代雅喜
所在地 : 〒105-0003 東京都港区西新橋1-17-11 (新橋東栄ビル2階)
設立 : 2018年4月
事業内容 : 海外における知的財産に関するコンサルティング業務
知財保護(調査・摘発)、知財関連申請業務代行
(1) ニセモノを発見し、模倣品工場の調査と摘発を行います。
(2) 安心、安全な版権投資及び各種の投資を実現します。
(3) 越境ECサイトの非正規流通を著作権侵害で摘発します。
(4) 商標登録の申請をアジア全域で迅速に実施します。
(5) 常時監視体制により効果的な冒認商標対策を実施します。
(6) NMPA(旧CFDA)等の政府機関への登録申請を迅速に実施します。
資本金 : 300万円
URL : https://wwip.co.jp/
本件についてのお問い合わせ先
WWIPコンサルティングジャパン
TEL:03-6206-1723 FAX:03-6206-6743
mail: official@wwip.co.jp