中国化粧品NMPA申請に伴う中国CMA認証試験機関における効果効能・安全性等試験の受託サービスを開始
2月7日、株式会社ワールドワイド・アイピーコンサルティングジャパン(以下、「WWIP」)は昨年から施行された新・中国化粧品監督管理条例(以下、「新条例」)の製品登録(製品・新原料)で要求される効能効果や安全性に関する試験の受託を開始しました。当試験は中国の国家認証制度であるCMA(China Metrology Accreditation / 中国計量認証認可制度)を取得した試験機関で実施するもので、WWIPは日本企業の要望に応え、中国CMA認証試験機関への試験委託の代行業務を行います。
1.NMPA(中国国家薬品監督管理局)は化粧品製品や化粧品新原料の申請にあたり以下の試験報告書を要求しています。
①化粧品効能表示に関する評価試験
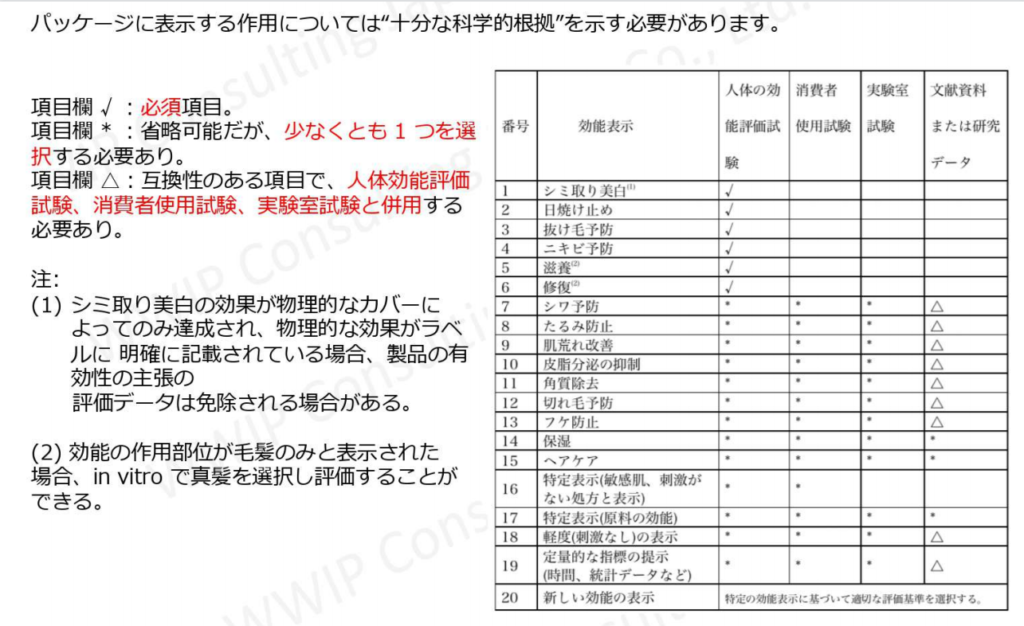
新条例の実務規定の一つ「化粧品の効能表示に関する評価規範」において、中国国内で販売される化粧品は効能表示評価を行う(第2条)と規定されました。
2022年1月以降、化粧品製品の申請者は、申請時に製品パッケージに表記された効能表示について「十分な科学的根拠」(第5条)が必要となります。
科学的根拠については効能により学術文献で足りるケース、日本国内での試験結果で対応できるケースがあるものの(一部の特別な効能は中国国内での試験が義務付けられています)、実務面では「合致する学術文献がない」、「日本国内で効能試験を実施していない」「日本国内で実施するにあたりNMPAが推奨している中国の業界標準にあわせた試験が実施できない」等の問題が生じています。
WWIPでは申請業務を行うにあたり、上記のような理由で結果的に中国のCMA認証試験機関で実施した試験結果報告書をエビデンスとしたケースが多くあることから、今回のサービスを開始しました。
②製品執行標準に伴う品質管理要件として要求される試験
新条例の実務規定の一つ「化粧品登録登記申請資料管理規定」において、化粧品製品を申請する際に製品を実際に管理する指標として微生物、重金属の品質管理措置の提出が要求されました。
品質管理措置として要求されている内容は、1)品質規格値2)試験方法(試験方法の名称と試験方法の概要)、3)試験頻度とされ、微生物及び物理化学指標の対象は、微生物関係では、1)コロニー総数、2)カビと酵母菌の総数、3)耐熱大腸菌、4)黄色ブドウ球菌、5)緑膿菌、 物理化学試験では、1)水銀、2)鉛、3)ヒ素、4)カドミウム、その他製品によりジオキサンやPhなどとなっています。
* 今後、稀なケースと考えられますが、新条例では中国行政当局が日本国内化粧品生産工場へ査察をすることも規定されており、査察時には品質管理措置の実施状況も確認対象となります。
日本国内の規定では製品に対してこのような継続的な品質管理は要求されておらず、多くの日本企業が対応に苦慮しています。
そのため、中国の要求にあわせた定期的な品質管理チェックを一括して中国CMA認証試験機関で実施するサービスを開始しました。
③新原料申請に伴う、安定性試験や毒理学試験
新条例下で新しい制度としてスタートした化粧品新原料申請は、昨年5月の施行以降、現在まで7件の新原料が登記されました。
新原料申請で要求される安全性や安定試験結果報告書は、日本国内の試験機関(GLP認証試験機関等)で実施されたものであれば、そのまま資料として提出することができますが、企業によって試験を実施していないケースも見受けられます。
このような日本企業のニーズにお応えする形で、WWIPでは、NMPA化粧品新原料申請で要求される安全性試験、安定性試験(苛酷・加速試験)等について中国CMA認証機関により試験を実施するサービスを開始しました。
2.試験を実施する試験機関
WWIPでは、北京、広州、西安にある中国国家認証(CMA)試験機関で日本企業の試験を受託できる体制を整えています。
3.試験費用
概算の試験費用、所要期間は「中国CMA認証試験期間による化粧品製品等の試験受託費用一覧」を参照してください。
WWIPの管理手数料は試験費用の一律15%を報告書納品時にご請求させて頂きます。
4.試験実施準備から報告まで
- ご希望の試験内容、現在の状況等をお知らせください。
- WWIPにて、ご希望に沿う試験機関の選定、お見積もり、所要期間等をご連絡します。
- 試験委受託契約を締結し試験費用のご請求をいたします。試験受委託契約に試験の内容、サンプル数等が明記されます。
- サンプルをWWIP宛にお送り頂きます。
- 試験費用のご入金を確認後、サンプルが試験機関に到着し次第、あらかじめ調整した試験日程により試験を実施します。
- 試験が終了した時点で、試験の結果を口頭で報告するとともに、データ版の報告書の作成を開始します。
- データ版の報告書が作成でき次第、データをお送りしますので内容をご確認ください。
- 内容がよろしければ、試験機関の押印が押された正規版を作成、WWIPに届き次第、貴社にお送りします。同時に弊社管理手数料15%のご請求書をお送りします。
5.注意点
- 化粧品効能表示に関する評価試験において中国国内での人体効能評価試験が義務付けられているものがありますが、その内の一部試験は、製品申請の基礎試験を実施した中国国内試験機関と調整と取る必要があります。(お問い合わせ頂いた際に確認します)
- 中国CMA認証試験期間による化粧品製品等の試験受託費用一覧は、複数の試験機関の費用、所要期間等により幅をもって記載しています。そのため、お問い合わせ頂いた時点で、製品申請の状況に併せて最適な試験機関を選定し正式なお見積もりを提出します。
* 試験機関によっては特急料金の設定があり、所要期間を大幅に短縮できる場合があります。
<本件に関するお問い合わせ>
株式会社WWIPコンサルティングジャパン
TEL : 03-6206-1723
Email: official@wwip.co.jp